Химико-фармацевтическое исследование оригинальных и воспроизведенных препаратов тамсулозина
Москалев А.В.1*, Огиенко А.Г.2,3,4, Мызь С.А.2,5, Огиенко А.А.2,6, Гладких В.С.1
1 ООО «ЭОЛ Лабс»
2 Новосибирский Государственный Университет
3 Институт неорганической химии им. А.В. Николаева СО РАН, Новосибирск
4 Лаборатория трансляционной медицины, Новосибирский Государственный Медицинский Университет
5 Институт химии твердого тела и механохимии СО РАН (ИХТТиМ СО РАН)
6 Институт молекулярной и клеточной биологии СО РАН (ИМКБ СО РАН)
Abstract
Препараты α1-адреноблокаторов в настоящее активно используются как препараты первого выбора при лечении симптомов со стороны нижних мочевыводящих путей (СНМП). Блокада α1а-адренорецепторов приводит к расслаблению гладкомышечных клеток стромы предстательной железы, что приводит к уменьшению симптомов обструкции. Тамсулозин блокирует α1a- и α1d-адренорецепторы, что позволяет ему эффективно бороться со всеми СНМП, при этом сосудистые осложнения возникают редко, в связи с малым влиянием на α1b-адренорецепторы.
Однако, эффективное терапевтическое воздействие препаратов данной группы возможно только при условии достижения необходимой концентрации действующего вещества в крови и ее удерживании в течение заданного времени. Данные характеристики определяются свойствами лекарственной формы в не меньшей, а нередко, в большей степени, чем свойствами самого действующего лекарственного вещества. На них очень сильно влияют выбор наполнителей и вспомогательных веществ, определяющих профиль высвобождения. Характеристики лекарственной формы могут радикально изменяться при замене одного из вспомогательных веществ, растворителя, из которого получают форму, а также вследствие изменения температурного режима без последующей оптимизации состава или нарушениях технологии производства. Целью данной работы было проведение сравнительного исследования физико-химических и фармацевтико-технологических характеристик препаратов на основе тамсулозина гидрохлорида, используемых в настоящее время в России (капсулы: «Омник», «Профлосин», «Фокусин», «Тамсулозин-OBL», «Тамсулозин (Вертекс)», «Тамсулозин Канон», «Омсулозин» и «Тулозин»; таблетки: «Омник Окас», «Тамсулозин Ретард»). Исследовались общие характеристики таблеток и капсул (сравнение составов лекарственных форм (используемые наполнители и носители), подлинность, средняя масса таблеток/содержимого капсул и ее однородность, прочность на раздавливание, распадаемость), морфология пленочного покрытия и материала ядер таблеток и содержимого капсул, гранулометрический состав содержимого капсул, химический и фазовый состав материала таблеток и капсул, а также профили высвобождения тамсулозина. Было показано, что изменение составов некоторых воспроизведенных препаратов по сравнению с оригинальным приводит к значительным изменениям их физико-химических свойств, что коррелирует со значительными различиями в динамике высвобождения тамсулозина. Установленные отличия потенциально могут влиять на эффективность терапевтического действия лекарственной формы и нуждаются в дальнейшем изучении in vivo.
Ключевые слова: тамсулозина гидрохлорид, альфа-адреноблокаторы, доброкачественная гиперплазия предстательной железы, корректор уродинамики, инструментальные методы исследования, оригинальные и воспроизведенные лекарственные препараты, эквивалентность.
1. Введение
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из наиболее распространённых заболеваний у мужчин трудоспособного и репродуктивного возраста. Клиническая картина ДГПЖ может быть очень разнообразной, начиная от бессимптомного протекания и заканчивая выраженным нарушением качества жизни. Хотя выраженные клинические проявления обнаруживаются только у 14% мужчин до 40 лет, с возрастом распространенность резко возрастает [1]. Для многих больных основными объективными проявлениями болезни являются нарушения мочеиспускания – учащение и затруднение, появление императивных позывов и чувство неполного опорожнения мочевого пузыря [2]. Боль и симптомы ирритативного или затруднённого мочеиспускания могут быть обусловлены обструкцией нижних мочевыводящих путей, вызванной, в свою очередь, дисфункцией шейки мочевого пузыря, сфинктера, стриктурой уретры или дисфункциональным мочеиспусканием с высоким уретральным давлением [3]. Таким образом, некоторые формы заболевания связаны с первоначальным нарушением функции симпатической нервной системы и гиперактивностью альфа-1-адренорецепторов. Турбулентное мочеиспускание с высоким внутриуретральным давлением вызывает рефлюкс мочи в протоки и дольки предстательной железы, который может стимулировать стерильную воспалительную реакцию [4].
В настоящее время в России активно применяются более девяти Тамсулозин-содержащих препаратов [5], выпускаемых различными производителями. Однако комплексное терапевтическое действие Тамсулозина может быть эффективным только при достижении необходимой концентрации действующего вещества в крови и ее удерживании в течение заданного времени. Одним из ключевых факторов, обеспечивающим необходимую концентрацию, является механизм контролируемого высвобождения. В связи с чем, целью нашей работы было проведение сравнительного исследования физико-химических и фармацевтико-технологических характеристик оригинальных и воспроизведенных препаратов тамсулозина.
2. Материалы и методы исследования
Объектами исследования являлись оригинальные и воспроизведенные препараты тамсулозина, выпускаемые в виде капсул («Омник», «Профлосин», «Фокусин», «Тамсулозин-OBL», «Тамсулозин (Вертекс)», «Тамсулозин Канон», «Омсулозин», «Тулозин») и таблеток («Омник Окас», «Тамсулозин Ретард»).
Изучение физико-химических характеристик включало исследование гранулометрического состава содержимого капсул методом оптической микроскопии, исследование морфологии пленочного покрытия /материала ядер таблеток и содержимого капсул методом сканирующей электронной микроскопии, исследование фазового состава пленочных оболочек, материала ядер таблеток и содержимого капсул методами порошковой рентгеновской дифракции и рамановской спектроскопии [6].
2.1 Анализ фармацевтико-технологических характеристик
Исследование включало анализ внешнего вида таблеток и капсул, определение средней массы и отклонений в массе таблеток и содержимого капсул (ГФ XIII ОФС.1.4.2.0009.15), прочность на раздавливание (ГФ XIII ОФС.1.4.2.0009.15), распадаемость таблеток и капсул (ГФ XIII ОФС.1.4.2.0013.15), изучение динамики растворения.
2.2 Метод сканирующей электронной микроскопии
Метод сканирующей электронной микроскопии (СЭМ) позволяет одновременно исследовать размеры и форму частиц, распределение частиц по размерам, а также получить изображение объекта в широком диапазоне увеличений.
Электронные микрофотографии образцов были получены с использованием настольного сканирующего электронного микроскопа TM-1000 (Hitachi). Для получения проводящей поверхности проводили напыление Au (толщина слоя 8 нм) в вакууме с использованием комплекса для напыления на препараты токопроводящих пленок (JFC-1600 Auto Fine Coater, Jeol).
2.3 Метод рамановской спектроскопии
Рамановская спектроскопия – неконтактный и неразрушающий метод анализа, позволяющий сохранить исследуемый образец для повторного многократного анализа с целью подтверждения результата. Для проведения анализа требуется минимальное количество материала, поскольку зондирующее излучение фокусируется в пятно диаметром около 2 мкм. Именно рамановская спектроскопия стала стандартным методом идентификации контрафактных лекарственных средств. В США она успешно применяется для контроля процесса производства фармацевтических препаратов в соответствии с требованиями FDA [6].
Раман-спектры регистрировались на спектрометре LabRAM HR Evolution (Horiba, Франция) оборудованном многоканальным CCD-детектором, охлаждаемым жидким азотом. Спектры возбуждались линией 514 нм Ar+-лазера мощностью около 1 мвт на поверхности образца. Спектры получены в геометрии обратного рассеяния с использованием микроскопа и диаметром пятна лазерного света на поверхности образца около 2 мкм. Спектральное разрешение спектрометра устанавливалось 3.0 см-1.
2.4 Порошковая рентгеновская дифракция
Метод порошковой рентгеновской дифракции используется для идентификации различных фаз в их смеси на основе анализа дифракционной картины образца.
Образец (пленочная оболочка/ядро таблетки; содержимое капсул) тщательно растирали в агатовой ступке и помещали в кювету дифрактометра Bruker D8 Advance (λ = 1.5406 Å). Порошковые дифрактограммы были записаны в режиме 2Θ сканирования в интервале 3-60 градусов с шагом 0.01 градуса при комнатной температуре (+20°C).
Отсутствие связанных асбестов в тальке было показано согласно ГФ XIII ФС.2.2.0017.15 «Тальк» (присутствие амфиболов определяют по наличию на дифрактограмме пиков в диапазоне 2θ: 10,5 ± 0,1°, а присутствие серпентинов – по наличию пиков в диапазонах 2θ: 12,1 ± 0,1, 24,3 ± 0,1°).
2.5 Изучение динамики растворения
Тест «растворение» проводили по фармакопее США (USP, Tamsulosin Hydrochloride Capsules, 2016, test 7) в аппарате «лопастная мешалка» (Varian 705 DS, США) со специальным проволочным приспособлением, препятствующим всплыванию капсул. Количество тамсулозина, перешедшего в среду растворения, определяли методом высокоэффективной жидкостной хроматографии («МилиХром А-02», ЗАО «Эконова»).
3 Результаты
На предварительном этапе исследования было проведено сравнение составов лекарственных препаратов тамсулозина, выпускаемых в виде таблеток с контролируемым высвобождением и капсул с модифицированным высвобождением.
Согласно инструкции к препарату [5], основой таблеток «Омник Окас» являются полиэтиленгликоли. В технологии производства твердых лекарственных форм (в данном случае, таблеток), они относятся к классу «связующих» вспомогательных веществ для таблетирования [7]. Так же их используют как пластификаторы, препятствующие разрушению, и как солюбилизаторы – вспомогательные вещества для улучшения абсорбции активной основы при грануляции плавлением. Следует отметить, что для распадающихся в желудке таблеток с увеличением содержания связующих веществ ухудшается распадаемость таблеток и скорость высвобождения лекарственного вещества. Таким образом, в случае таблеток препарата «Омник Окас» (таблетки с контролируемым высвобождением), на основании указанных выше данных следует ожидать некоторых особенностей. Во-первых, значительного превышения прочности таблеток (минимум 3-4х) относительно рекомендованных минимальных значений (ГФ XIII ОФС.1.4.2.0011.15). Во-вторых, вследствие достаточно высоких температур плавления (65-72°С для полимеров с молекулярной массой >2000), отсутствия разрыхляющих вспомогательных веществ в рецептуре таблетки (в данном случае в них нет необходимости) в тестах распадаемости таблеток все рекомендованные времена (ГФ XIII ОФС.1.4.2.0013.15) для них будут существенно превышены. В-третьих, само поведение таблеток в тесте будет отличаться от желудочно-растворимых таблеток («набухание/образование геля/расширение/растворение» вместо разрушения либо растворения).
Основой таблеток «Тамсулозин Ретард» являются гипромеллоза (гидроксипропилметилцеллюлоза) и микрокристаллическая целлюлоза (МКЦ). МКЦ широко используется в производстве твердых лекарственных форм в основном в качестве наполнителя, также проявляющего связующие и улучшающие скольжение свойства [8]. Гипромеллоза, в зависимости от сорта, используется как компонент пленочного покрытия, связующий агент, дизинтегратор, агент для кишечнорастворимого покрытия, а также широко используется как гидрофильный матричный агент. Основным преимуществом матричных таблеток с использованием гипромеллозы является легкость управления профилем растворения с помощью выбора специфического сорта с определенной вязкостью, изменения содержания гипромеллозы в таблетке и размера (и прочности) таблетки.
Пленочное покрытие таблеток обоих препаратов относится к типу желудочно-растворимого, и используется в большей степени для улучшения потребительских качеств таблетки.
Таким образом, полная замена основы таблетки в препарате «Тамсулозин Ретард» по сравнению с «Омник Окас», в принципе, не является препятствием для создания дженерика со сходным профилем высвобождения, вследствие возможности варьировать достаточно большое количество параметров как самой таблетки (размер/форма/прочность), так и состава таблеточной массы. Однако, в связи с меньшей массой таблетки, с меньшей массой самой твердой дисперсной системы на базе гипромеллозы (являющейся основой матрикса таблетки), и с большей массовой долей тамсулозина («Омник Окас»: 0,1607 % (400 мкг/248,85 мг); «Тамсулозин Ретард»: 0,3125% (400 мкг/128 мг)) можно предположить, что величины прочности таблеток будут сильно превышены относительно не только рекомендованных минимальных значений, но и относительно таблеток препарата «Омник Окас»
Сравнение инструкций к препаратам тамсулозина, выпускаемых в форме капсул [5], показал, что все они относятся к типу капсул с модифицированным высвобождением (имеют в составе оболочки или содержимого специальные вспомогательные вещества, предназначенные для изменения скорости или места высвобождения действующих веществ). Классификация по составу основы содержимого капсул (пеллеты/гранулы) препаратов тамсулозина дает возможность разделить их на две группы:
- качестве инертной основы используется МКЦ («Омник», «Профлосин», «Фокусин», «Омсулозин», «Тулозин»)
- В качестве инертной основы используется сахароза («Тамсулозин-OBL», «Тамсулозин (Вертекс)», «Тамсулозин Канон»).
Здесь следует отметить, что для всех препаратов основой (носитель) содержащей тамсулозин твердой дисперсной системы [9] являются сополимеры метакриловой кислоты и этилакрилата (полиметилметакрилаты (ПММА)), однако распределение этого компонента между ядром и оболочкой в явном виде указано только для следующих препаратов: «Фокусин» (ядро и оболочка), «Тамсулозин-OBL» (только оболочка), «Тамсулозин (Вертекс)» (только оболочка), «Омсулозин» (ядро и оболочка). Помимо использования в виде оболочек, ПММА может применяться и в качестве матрицы для создания лекарственных форм, обеспечивающих замедленное высвобождение действующего вещества в организме человека, тем самым продлевая его терапевтический эффект.
Уже на основании рассмотренных данных можно сделать следующие предположения:
- Вследствие практически 10-кратного различия в количестве основы содержащей тамсулозин твердой дисперсной системы препаратов «Омник» (400мкг/42,5мг/распределено по всей грануле) и «Тамсулозин (Вертекс)» (400мкг/4,8мг/оболочка пеллеты), именно в этом случае следует ожидать значительных различий в количестве высвободившегося тамсулозина в различных контрольных точках от начала испытания.
- Пеллеты препарата «Тамсулозин-OBL» должны иметь наибольшую толщину оболочки (причем действующее вещество может находиться только в оболочке). Необходимость предотвратить растворение оболочки в желудке (использовать ПММА, придающие оболочке желудочно-резистентные свойства) и наличие в составе оболочки гипромеллозы (17,5 % масс.) дает возможность предположить низкое количество высвободившегося тамсулозина на первой контрольной точке через 2 часа после начала испытания (2 часа в 0,1 Н HCl) и превышение на следующей контрольной точке.
Результаты проведенных экспериментов показали, что по показателям подлинности, средней массы и отклонений в массе таблеток и содержимого капсул различий между всеми исследованными препаратами выявлено не было. Для всех исследованных препаратов не было зафиксировано наличия примесей кристаллических фаз, не соответствующих заявленному составу. Для препаратов, содержащих тальк в составе оболочки таблеток («Тамсулозин Ретард») / оболочки (либо пеллеты и оболочки) содержимого капсул препаратов «Омник» (производства ЗАО «ОРТАТ» и ЗАО «ЗиО-Здоровье»), «Профлосин», «Фокусин», «Тамсулозин-OBL», «Тамсулозин Канон», «Омсулозин» и «Тулозин», было показано отсутствие связанных асбестов.
Разрушающая сила для таблеток препаратов «Омник Окас» (122±10 Н) и «Тамсулозин Ретард» (143±17 Н) превышает минимальное рекомендованное значение (30 Н) для таблеток данных диаметров (Ø9, Ø7). Вычисленные на основании полученных данных величины прочности таблеток [10,11] значительно превышают как рекомендованные(0,5 МПа) для данных диаметров («Омник Окас»: в 4 раза (2,0 МПа); «Тамсулозин Ретард»: в 9 раз (4,54 МПа)), так и прочности представленных на российском рынке таблеток некоторых препаратов близкого размера. Вследствие отсутствия в рецептурах таблеток полимеров с рН-зависимым высвобождением, использование подобной твердой дисперсной системы тамсулозина на основе «пластификаторов» («Омник Окас»), либо гипромеллозы («Тамсулозин Ретард») дает возможность модифицировать (пролонгировать) высвобождение тамсулозина только за счет отсутствия «разрыхляющих» вспомогательных веществ и создания таблеток высокой прочности, что должно изменять характер растворения таблеток (медленное «набухание» с последующим медленным растворением вместо быстрого распада таблеток).
Наибольшее значение прочности (среднее значение 22±4 Н) зафиксировано для содержимого капсул препарата «Омсулозин», что может быть связано с наибольшим (среди всех исследованных препаратов) содержанием полимерной основы (сополимер метакриловой кислоты и этилакрилата, 28,7 масс. %) и наименьшим содержанием МКЦ. Наименьшие значения прочности (средние значения: 6 Н и менее) содержимого капсул зафиксированы для препаратов, содержащих сахарозу в качестве основного (или единственного) компонента «инертных пеллет».
Экспериментами по определению времени распадаемости было показано, что таблетки препаратов «Омник Окас» и «Тамсулозин Ретард» полностью растворяются через 12 часов после начала эксперимента (через 10 часов после замены среды растворения). Оболочки капсул всех препаратов не имеют желудочно-резистентного покрытия. Пролонгированное высвобождение тамсулозина в этом случае достигается наличием полимерного носителя с рН-зависимой растворимостью, входящего в состав самих пеллет, либо их оболочек.
Результаты гранулометрического анализа содержимого капсул представлены на рисунке 1. Для группы препаратов с использованием сахарозы в качестве инертной основы («Тамсулозин-OBL», «Тамсулозин (Вертекс)», «Тамсулозин Канон») характерно довольно узкое распределение гранул/пеллет по размерам (размеры 900-1200 мкм). В то же время для препаратов с использованием МКЦ в качестве инертной основы пеллет («Омник», «Профлосин», «Фокусин», «Омсулозин», «Тулозин») характерно наличие большего числа пеллет меньшего размера и, как следствие, более широкое распределение по размерам. Данные изменения могут быть связаны с технологическими затруднениями, возникающими на одном или нескольких этапах при использовании пеллет из сахарозы меньшего размера: а) при гранулировании либо подсушивании (разрушение/пыление); б) нанесении покрытия (пыление/слипание частиц).
Изменение распределения частиц содержимого капсул по размерам (например, со среднего размера 600 мкм до 1100 мкм) даже при сохранении рецептуры (для любого из препаратов) повлечет за собой изменение профиля высвобождения (снижение) вследствие:
- На ранних стадиях растворения – уменьшения удельной поверхности;
- На поздних стадиях растворения – увеличения радиуса частиц при том же соотношении анионной/нейтральной форм сополимеров (при условии сохранения рецептуры).
Таким образом, уже только изменение гранулометрического состава повлечет за собой необходимость корректировки рецептуры для обеспечения заданного профиля высвобождения. Полное же изменение списка используемых вспомогательных веществ повлечет за собой необходимость решения многопараметрической задачи подбора носителей и порядка их смешивания, растворителей для увлажнения, физико-химических характеристик комбинации сополимеров (сюда же включаем необходимость определения соотношения сополимеров), размера и прочности инертных гранул (при их использовании), состава и физико-химических характеристик оболочки.
На основании полученных данных можно предположить, что подобие составов препаратов «Омник», «Профлосин», «Фокусин» и распределения содержимого капсул по размерам дает возможность более простого решения задачи по обеспечению заданного профиля высвобождения тамсулозина из этих дженериковых аналогов и так же более простой способ влияния на высвобождение тамсулозина на первой контрольной точке (снижение): использование для создания пленочной оболочки преимущественно анионной формы сополимеров метакриловой кислоты. В свою очередь, наличие меньшего числа частиц большего размера, при содержании включающей тамсулозин твердой дисперсной системы на основе сополимеров метакриловой кислоты только в составе оболочки («Тамсулозин-OBL» и «Тамсулозин (Вертекс)») делает обеспечение требуемого профиля высвобождения более сложной задачей. Дополнительное же пропитывание инертных пеллет раствором тамсулозина (для чего необходимо подобрать органический растворитель, с котором растворимость сахарозы отлична от 0; в противном случае дополнительное пропитывание приведет только к пылению и неравномерному содержанию тамсулозина) с целью обеспечить высвобождение в отделах ЖКТ с высокими значениями рН мы считаем маловероятным вследствие того, что оно не только не гарантирует пролонгированного высвобождения (хорошая растворимость сахарозы), но и повлечет за собой необходимость:
А) использования только анионной формы сополимеров в рецептуре оболочки пеллет для предотвращения их растворения в желудке, следствием чего будут близкие к 0% значения высвобождения на первой контрольной точке и почти полное высвобождение во второй контрольной точке, либо
Б) использования двухслойного покрытия либо комбинации сополимеров в анионной и нейтральной формах для обеспечения отличного от 0% высвобождения в желудке, опять же с последующим быстрым высвобождением во второй контрольной точке.
Таким образом, на основании результатов экспериментов по определению гранулометрического состава, по определению прочности содержимого каспул и анализа составов пеллет исследованных препаратов, в случае препарата «Тамсулозин (Вертекс)» следует ожидать значительных различий в количестве высвободившегося тамсулозина на первой контрольной точке после смены буфера (2 часа в фосфатном буфере) (существенное превышение либо практически полное высвобождение).
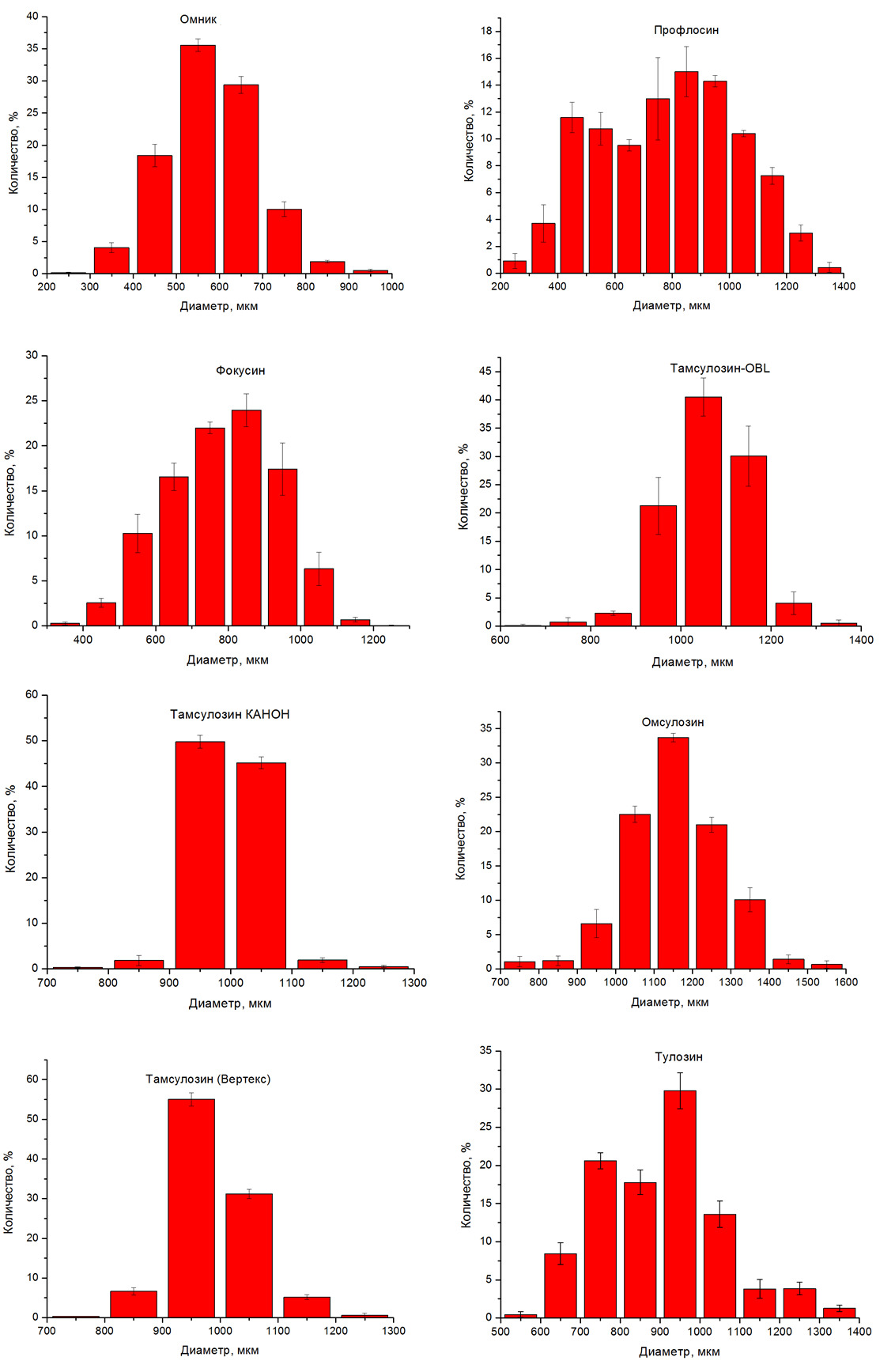
Рисунок 1. Гранулометрический состав содержимого капсул исследуемых препаратов.
Исследование с использованием метода сканирующей электронной микроскопии показало, что ядра таблеток препарата «Тамсулозин Ретард» отличаются от ядер таблеток «Омник Окас» практически плоскими поверхностями сколов и отсутствием межзерновых трещин, что свидетельствует о применении существенно больших усилий прессования и подтверждается большими, чем для таблеток «Омник Окас», значениями прочности таблеток.
Исследование содержимого капсул показало, что гранулы/пеллеты всех исследованных препаратов имеют пленочную оболочку, даже в случаях, когда это явно не указано в инструкциях к препаратам. Наименьшую толщину пленочной оболочки имеют гранулы препарата «Омник» (производства ЗАО «ОРТАТ» и ЗАО «ЗиО-Здоровье») (~ 3 мкм) и пеллеты препарата «Тулозин» (5 мкм). Наибольшую толщину пленочного покрытия (до 50 мкм) имеют пеллеты препарата «Тамсулозин-OBL» (рис. 2).
Анализ внутреннего строения гранул/пеллет позволяет разделить препараты на 3 группы (рис. 2):
- Умеренно-плотная волокнистая структура (все препараты, содержащие МКЦ в качестве инертного наполнителя).
- Однородная плотная структура с наличием небольшого количества полостей («высохшая паста»): «Тамсулозин (Вертекс)».
- Неоднородное строение гранул/пеллет в направлении от центра к поверхности: кристаллы (сферонизованные, 10-20 мкм) в центре, однородная плотная структура на поверхности: «Тамсулозин-OBL», «Тамсулозин Канон».
Основой инертных пеллет групп 2 и 3, согласно инструкциям к препаратам, является сахароза. Вероятно, причиной неоднородного строения является меньшее количество увлажняющего агента (вода) при изготовлении инертных пеллет в случае препаратов «Тамсулозин-OBL», «Тамсулозин Канон». С использованием метода рамановской спектроскопии было проведено исследование неоднородности строения гранул/пеллет в направлении от центра к поверхности препаратов «Тамсулозин-OBL» и «Тамсулозин Канон», которое показало, что наблюдавшиеся на снимках СЭМ сферизованные кристаллы относятся к фазам сахарозы и крахмала, входящих в состав «инертных пеллет» этих препаратов. Материал пеллет препарата «Тамсулозин (Вертекс)» был идентифицирован как сахароза.
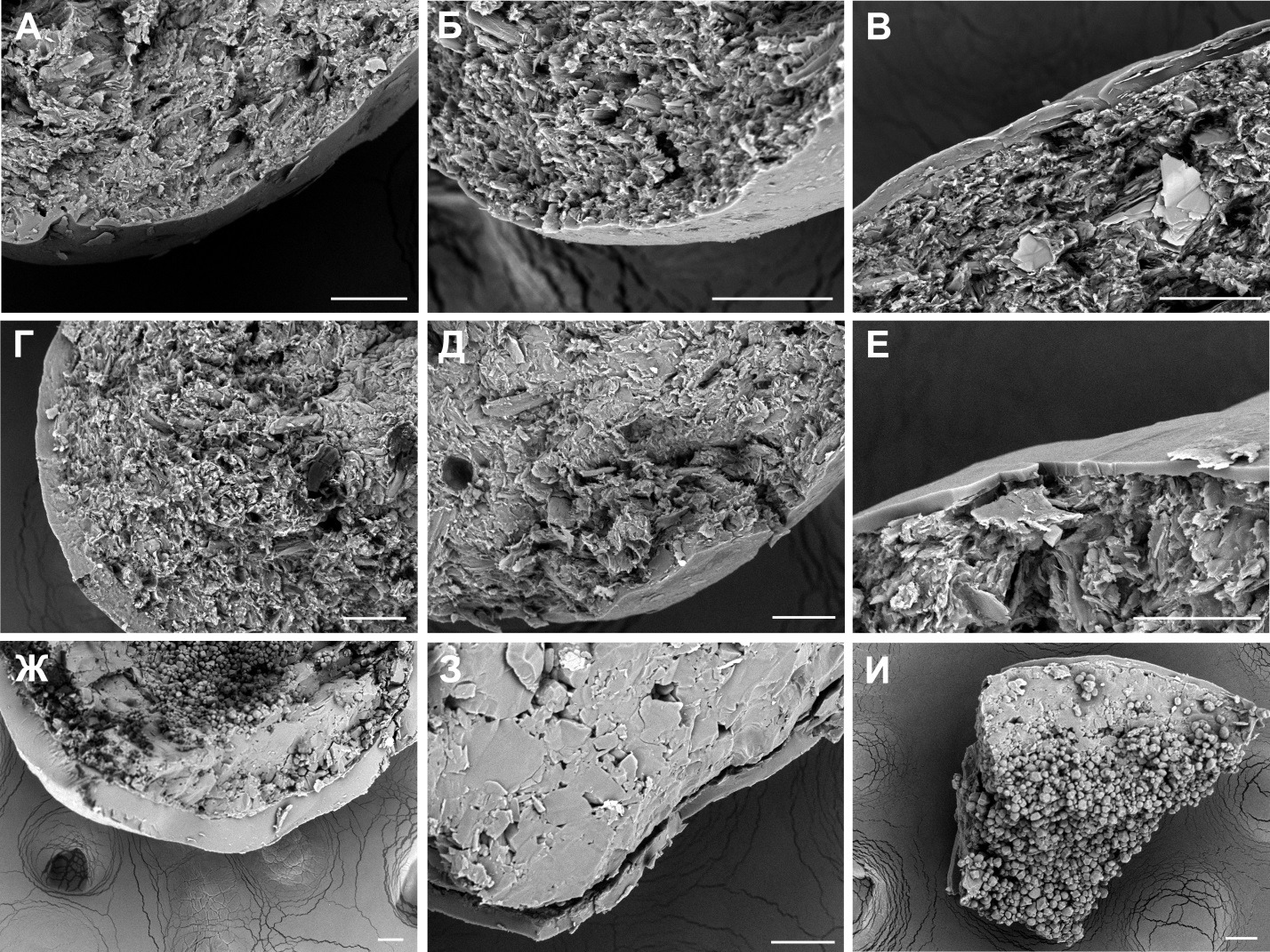
Рисунок 2. Характерные микрофотографии содержимого капсул препаратов «Омник» (ЗАО «ОРТАТ») (А), «Омник» (ЗАО «ЗиО-Здоровье») (Б), «Профлосин» (В), «Фокусин» (Г), «Омсулозин» (Д), «Тулозин» (Е), «Тамсулозин-OBL» (Ж), «Тамсулозин (Вертекс)» (З), «Тамсулозин Канон» (И). Масштабный отрезок 50 мкм.
Испытание «Растворение» предназначено для определения количества действующего вещества, которое в условиях, указанных в фармакопейной статье или нормативной документации, за определенный промежуток времени должно высвобождаться в среду растворения из твердой дозированной лекарственной формы. Испытание «Растворение» проводится при контроле качества лекарственной формы для подтверждения постоянства ее свойств и надлежащих условий производственного процесса.
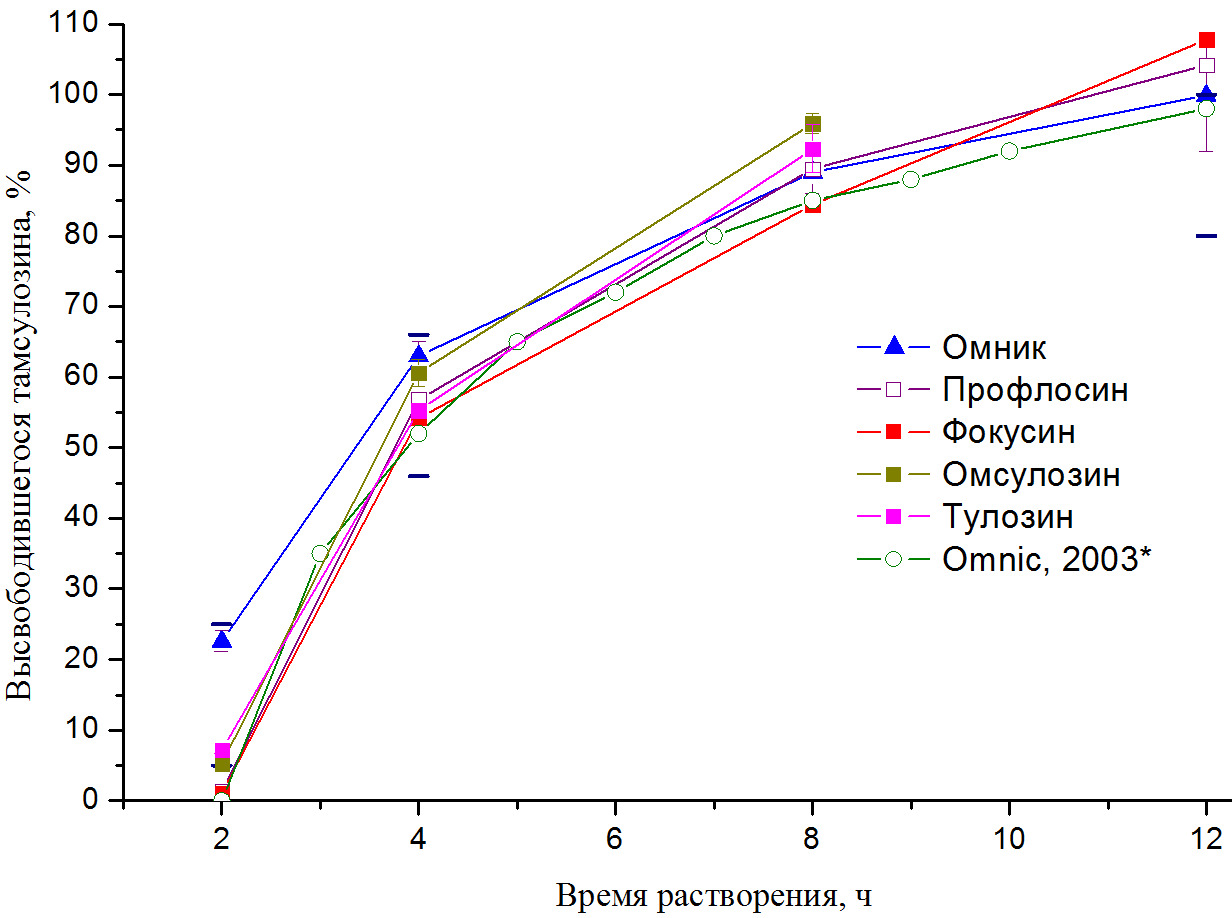
Рисунок 3. Сравнение профилей высвобождения тамсулозина из капсул препаратов с преимущественным использованием МКЦ в качестве инертной основы, полученных в данной работе, с данными, полученными для препарата «Omnic» [12]. Рекомендованные параметры высвобождения тамсулозина (согласно USP) отмечены темно-синими штрихами.
По результатам теста «Растворение» препараты «Профлосин» и «Фокусин» имеют сходные профили высвобождения и достоверно отличаются от препарата «Омник» (Рис. 3). Так, низкое высвобождение тамсулозина в первой контрольной точке («Профлосин»: 1,4%, коэффициент вариабельности 50%; «Фокусин»: 0,7%; коэффициент вариабельности 57%) дает возможность предположить более позднее начало действия этих препаратов. Кроме того, быстрое высвобождение при смене среды растворения (содержимое капсулы попадает в отделы ЖКТ с высокими рН (кишечник)) и резкий рост концентрации тамсулозина (десятки раз по сравнению с 2,8-кратным в случае «Омник») увеличивает вероятность побочных эффектов (токсического действия) вследствие возможного превышения минимальной токсической концентрации [7].
Для препаратов «Омсулозин» и «Тулозин» также характерны низкие величины высвобождения тамсулозина на первой контрольной точке («Омсулозин»: 5,3 %, коэффициент вариабельности: 19%; «Тулозин»: 7,2%, коэффициент вариабельности: 7%), укладывающиеся, тем не менее, в рекомендованный (USP) диапазон величины высвобождения для первой контрольной точки (5÷25 %).
Таким образом, только препараты «Омник», «Омсулозин» и «Тулозин» успешно проходят тест растворения и соответствуют рекомендованным (USP) значениям высвобождения активного ингредиента.
В работе [12], посвященной разработке прецизионного экспресс-метода определения высвобождения тамсулозина с использованием ВЭЖХ, было показано полное отсутствие высвобождения тамсулозина из оригинального препарата «Omnic» даже при выдерживании в течение 12 часов в кислой среде (pH=1,2). Этим авторы работы [12] объясняют длительный период достижения максимальной концентрации тамсулозина в плазме крови (tmax ~ 6 часов, здоровые добровольцы) при его быстрой адсорбции из ЖКТ, о чем сообщалось в обзоре C.I. Dunn с соавторами [13]. Следует отметить, что все дженериковые аналоги препарата «Омник» с преимущественным использованием МКЦ в качестве инертной основы имеют сходные с «ранним» препаратом «Omnic» [12] профили высвобождения (рис. 3). Мы предлагаем этому следующее объяснение: накопленные за первые 10 лет применения оригинального препарата данные (эффективность, фармакокинетические параметры, наличие и частота побочных эффектов, так же как и корреляции между этими параметрами) привели к необходимости изменения профиля высвобождения тамсулозина из содержимого капсул «Омник». Следует отметить простоту и изящность решения поставленной задачи: в данном случае профиль высвобождения однозначно задается изменением соотношения «нейтральной» и «анионной» форм используемых сополимеров (см., например [14,15]). Для подтверждения данной гипотезы необходимо сравнить полученный в данной работе профиль высвобождения тамсулозина из капсул препарата «Омник» (РФ), с профилями высвобождения тамсулозина из капсул препаратов «Flomax®» или «Omnic®» (ЕС / США).
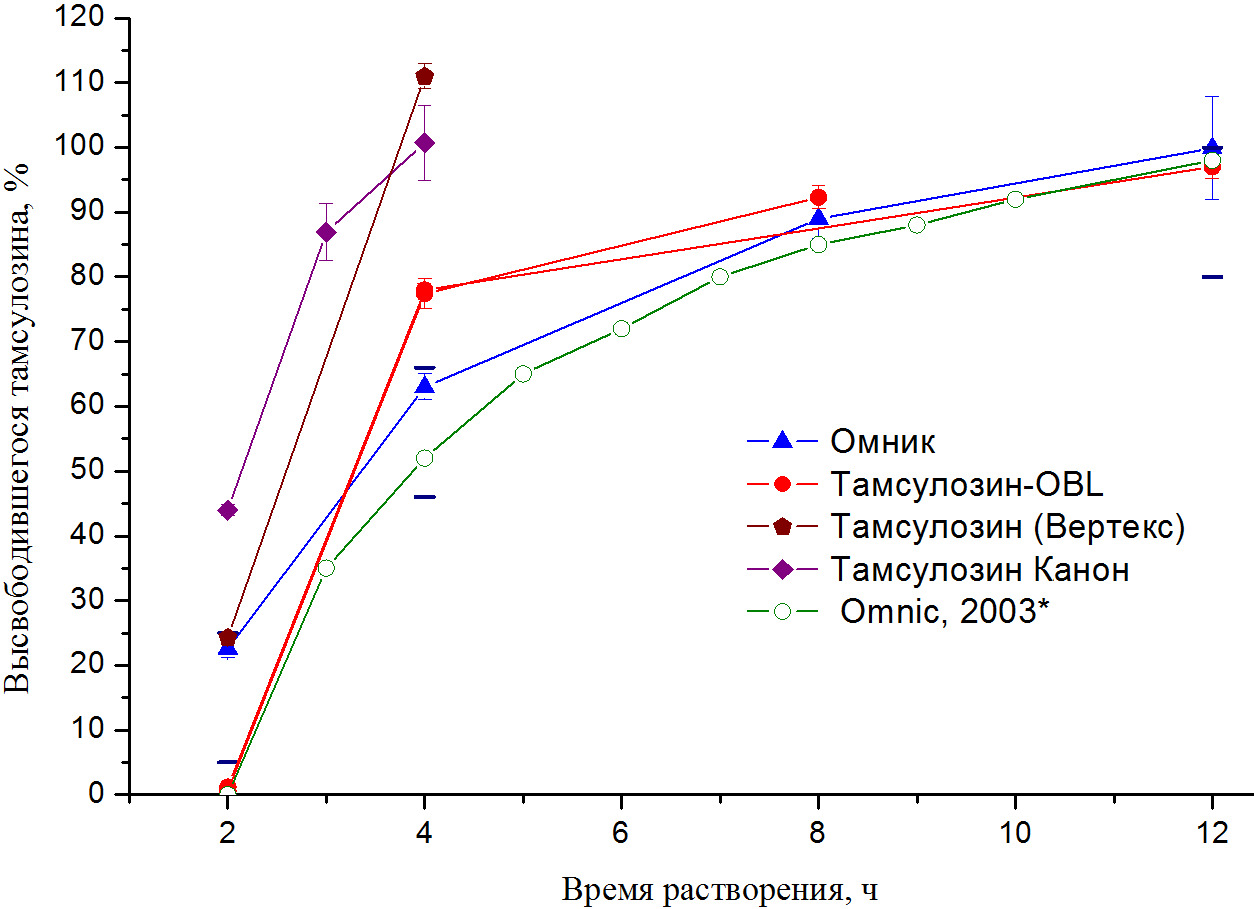
Рисунок 4. Сравнение профилей высвобождения тамсулозина из капсул группы препаратов, с использованием сахарозы в качестве инертной основы, с препаратом «Омник», и с данными, полученными для препарата «Omnic» [12]. Рекомендованные параметры высвобождения тамсулозина (согласно USP) отмечены темно-синими штрихами.
Параметры высвобождения тамсулозина из капсул препаратов с преимущественным использованием сахарозы в качестве инертной основы («Тамсулозин-OBL», «Тамсулозин (Вертекс)», «Тамсулозин Канон») не соответствуют рекомендованным (USP) значениям высвобождения активного ингредиента и, таким образом, все препараты этой группы не проходят тест растворения (рис. 4).
Например, высвобождение тамсулозина на первой контрольной точке через 2 ч от начала испытания соответствует рекомендованному только в случае капсул препарата «Тамсулозин (Вертекс)» (24,3%; рекомендованный диапазон: 5÷25 %). В случае препаратов «Тамсулозин-OBL» и «Тамсулозин Канон» значения высвобождения тамсулозина на первой контрольной точке существенно ниже (~ 1 %) и выше (44%) рекомендованных. Для препарата «Тамсулозин-OBL» высвобождение тамсулозина во второй контрольной точке существенно превышает рекомендованное (рис. 4). Для препаратов «Тамсулозин (Вертекс)» и «Тамсулозин Канон» полное высвобождение тамсулозина было зафиксировано уже во второй контрольной точке (2ч после замены среды на pH=7,4; рекомендовано: 44÷66%): 111,0 и 100,7%, соответственно. Одним из объяснений превышения измеренной величины высвобождения тамсулозина над заявленной дозировкой для препарата «Тамсулозин (Вертекс)» может быть очень малое количество основы содержащей тамсулозин твердой дисперсной системы (практически в 10 раз меньше относительно препарата «Омник»): изменение массы сополимера на 1 мг приведет к относительной ошибке в 2,3% для препарата «Омник» и 21% для «Тамсулозин (Вертекс)». В случае препарата «Тамсулозин Канон» было дополнительно определено высвобождение тамсулозина через 1 час после замены среды на pH=7,4: величина высвобождения (86,9%) также оказалась на уровне рекомендованной величины высвобождения в третьей контрольной точке (10ч после замены среды на pH=7,4; рекомендовано: не менее 80%). Вследствие быстрого высвобождения тамсулозина, мы предполагаем, во-первых, увеличение вероятности побочных эффектов вследствие резкого роста концентрации тамсулозина в плазме крови пациентов за счет быстрого высвобождения при смене среды растворения (содержимое капсулы попадает в отделы ЖКТ с высокими рН (кишечник)), а во-вторых, наименьшую эффективность препаратов «Тамсулозин (Вертекс)» и «Тамсулозин Канон» среди исследованных в данной работе препаратов, вследствие возможного быстрого выведения тамсулозина.
3.1 Обсуждение
В основе клинической эффективности действующего вещества тамсулозин гидрохлорид лежит его способность селективно блокировать постсинаптические α1A-адренорецепторы гладких мышц предстательной железы, шейки мочевого пузыря, простатической части уретры [16,17]. Это взаимодействие снижает тонус гладких мышц, что облегчает отток мочи и одновременно уменьшает симптомы обструкции и раздражения, связанные с доброкачественной гиперплазией предстательной железы. Воздействие приводит к облегчению мочеиспускания, снижению болевого синдрома, устранению никтурии и, как следствие, повышению качества сна и улучшению качества жизни пациента [18]. Значительно меньше выражена у тамсулозина способность блокировать α1B-адренорецепторы гладких мышц сосудов. Поэтому действие на системное АД при поддержании в крови нормативной концентрации незначительно, что особенно важно для пациентов пожилого возраста. Внезапное резкое снижение артериального давления не только приводит к повышению нагрузки на сердечно-сосудистую систему, но и вызывает резкую слабость, вплоть до обморока, что для возрастных пациентов означает риск травмы или перелома [19].
Выраженный терапевтический эффект проявляется приблизительно через 2 недели от начала лечения при ежедневном применении, т.е. прием препарата имеет накопительный эффект. Однако, терапевтическое воздействие тамсулозина с учетом накопительного эффекта возможно только при соблюдении трех условий:
- Отсутствие вредных примесей и соответствие заключенной в таблетки/капсулы лекарственной формы заявленному составу и химическому строению/полиморфной модификации/энантиомеру действующего вещества;
- поддержание содержания препарата в крови выше минимальной терапевтической дозы до следующего приема препарата (принимается 1 раз в сутки). Данный эффект достигается за счет замедленного высвобождения действующего вещества из лекарственной формы [20];
- поддержание содержания препарата в крови НЕ выше максимальной рекомендованной дозы. Превышение содержания вещества в крови приводить к серьезным нежелательным эффектам, начиная от влияния на тонус гладкой мускулатуры сосудов и незначительной слабости и астении, и вплоть до резкого изменения давления и обмороков. Данный эффект обеспечивается желудочно-резистентными свойствами оболочки (таблеток и капсул), а также замедленным высвобождением и всасыванием [20] действующего вещества из лекарственной формы в тонком кишечнике.
При нарушении любого из данных условий, препарат в лучшем случае не сможет оказывать полноценного терапевтического воздействия, а в худшем – его прием приведет к возникновению серьезных неблагоприятных последствий для организма. Например, использование субстанции сильденфила цитрата ненадлежащего качества (вредные примеси) может существенно увеличить риск возникновения серьезных побочных эффектов [21]. Известны также примеры рацемических препаратов, в которых один из стереоизомеров обладал сильным токсическим эффектом, что приводило к трагическим случаям. Например, R-талидомид является мощным транквилизатором, в то время как S-талидомид обладает тератогенным действием и представляет наибольшую опасность на ранних стадиях беременности [22]. Вероятность появления ребёнка с физическими деформациями появляется после приёма всего одной таблетки талидомида в этот промежуток времени (т.н. «Талидомидная катастрофа», 1960-е годы).
Замедленное высвобождение действующего вещества в ЖКТ обеспечивается в случае тамсулозина специально созданной для данного действующего вещества лекарственной формой. Замена любого из компонентов данной сложной сбалансированной твердой дисперсной системы «действующее вещество – полимерные носители – вспомогательные вещества» приведет к изменению всей модели и потребует не только изменения остальных параметров для сохранения аналогичных с оригинальным препаратом фармакокинетических свойств, но и проверки устойчивости вновь созданной композиции в течение всего срока хранения в условиях переменной температуры/влажности и т.д. Ранее на примере такролимуса, широко используемого иммунодепрессанта, применяемого при пересадке органов, было показано, что кристаллизация из аморфного состояния происходит чаще в случае дженериков, содержащих действующее вещество в виде физической смеси с полимерами, а не в виде твердой дисперсной системы [23]. С увеличением степени кристалличности критически уменьшается растворимость [24], что может привести к резкому падению эффективности при использовании первоначальных доз без мониторинга концентрации такролимуса в крови и, таким образом, к отторжению пересаженного органа.
Разработка нового дизайна препарата возможна, однако является сложной многопараметрической задачей. Как правило, исходя из зарубежного опыта разработки сложных моделей препаратов, это требует большого количества времени, средств, фармакологических и клинических исследований [25,26]. В результате успешных разработок высокотехнологичных препаратов научные результаты подобной работы являются самодостаточными для публикации и принимаются высокорейтинговыми журналами (см. напр., [27-29]). В случае исследованных дженериков тамсулозина нам не удалось обнаружить в научной литературе статей по разработке нового дизайна препарата с замедленным высвобождением ни для одного из них. Надежным способом, позволяющим подтвердить эффективность «измененной» лекарственной формы, являются клинические исследования. Однако, для регистрации дженериков они не являются обязательными. Можно предположить, что в отсутствии обязательных процедур контроля, рынок РФ получает препараты, произведенные по наиболее дешевому дизайну.
3.2 Заключение
В отличие от препаратов с преимущественным использованием МКЦ в качестве инертной основы (все препараты зарубежного производства), для которых характерны подобные ранней версии препарата «Omnic» [12] профили высвобождения (пролонгированное высвобождение), все препараты с использованием сахарозы в качестве инертной основы (производство локализовано в РФ) имеют статистически различимые профили высвобождения, не эквивалентные ни ранней версии препарата «Omnic», ни препарату «Омник», производство которого локализовано в РФ. Таким образом, вопрос о том, являются ли воспроизведенные препараты «Тамсулозин-OBL», «Тамсулозин (Вертекс)», «Тамсулозин Канон» фармацевтически и терапевтически эквивалентными оригинальному является актуальным и открытым. Согласно полученным результатам следует ожидать существенного снижения фармакологической эффективности, и, как следствие, терапевтического потенциала этих препаратов и для доказательства их безопасности и эффективности необходимо проведение дополнительных исследований (напр., сравнительные фармакокинетические исследования с привлечением здоровых добровольцев).
Авторы выражают благодарность д.х.н. Б.А. Колесову за запись КР-спектров.
3.3 Список литературы
1. Атаманова Е.А., Андрюхин М.И., Макаров О.В. Прогностическое значение кровотока предстательной железы у больных острой задержкой мочеиспускания на фоне доброкачественной гиперплазии предстательной железы //Вестник Российского университета дружбы народов. Серия: Медицина. – 2014. – №. 3. – Стр. 52-57.
2. Урология. Российские клинические рекомендации / под ред. Ю.Г. Аляева, П.В. Глыбочко, Д.Ю. Пушкаря. – 2017. – 544 с.
3. Братчиков О.И., Тюзиков И.А., Шумакова Е.А., Гресь А.А., Чураев С.А. Клинико-уродинамическая эффективность и безопасность различных режимов фармакотерапии у мужчин с симптомами нижних мочевых путей/доброкачественной гиперплазией предстательной железы в зависимости от андрогенного статуса //Тихоокеанский медицинский журнал. – 2016. – №. 1 (63). – Стр. 29-32.
4. Сивков А.В., Ощепков В.Н., Кешишев Н.Г., Шкабко О.В. Опыт лечения пациентов с хроническим неинфекционным простатитом // Медицинский Совет. 2011. №7-8. – Стр.65-68.
5. Официальный электронный ресурс «Государственный Реестр Лекарственных Средств» (http://grls.rosminzdrav.ru) Минздрава России.
6. Руководство по инструментальным методам исследования при разработке и экспертизе качества лекарственных препаратов / под ред. С.Н. Быковкого, И.А. Василенко, М.И. Харченко, А.Б. Белова, И.Е. Шохина, Е.А. Дориной. М.: Перо, 2014.
7. Меньшутина Н.В., Мишина Ю.В., Алвес С.В. Инновационные технологии и оборудование фармацевтического производства. Т1. М.: Издательство БИНОМ, 2012, 328с.
8. Аутлов С.А., Базарнова Н.Г., Кушнир Е.Ю. Микрокристаллическая целлюлоза: структура, свойства и области применения (обзор) // Химия растительного сырья, 2013, 3, 33-41.
9. Leuner C., Dressman J. Improving drug solubility for oral delivery using solid dispersions // European Journal of Pharmaceutics and Biopharmaceutics, 2000, 50(1), 47-60.
10. Fell J.T., Newton J.M. Determination of tablet strength by diametral compression test // Journal of Pharmaceutical Sciences, 1970, 59, 688–691.
11. Pitt K.G., Heasley M.G. Determination of the tensile strength of elongated tablets // Powder Technology, 2013, 238, 169-175.
12. Aboul-Enein H.Y., Hussein R.F., Radwan M.A., Yusuf A., Al-Ahmadi W., Al-Rawithi S. Tamsulosin dissolution from pharmaceutical dosage forms using an automated HPLC system // Journal of Liquid Chromatography & Related Technologies, 2003, 26(7), 1109-1116.
13. Dunn C.J., Matheson A., Faulds D.M. Tamsulosin – A review of its pharmacology and therapeutic efficacy in the management of lower urinary tract symptoms // Drugs & Aging, 2002, 19(2), 135-161.
14. Palmieri G.F., Michelini S., Di Martino P., Martelli S. Polymers with pH-dependent solubility: Possibility of use in the formulation of gastroresistant and controlled-release matrix tablets. Drug Development and Industrial Pharmacy, 2000, 26(8), 837-845.
15. Palmieri G.F., Bonacucina G., Di Martino P., Martelli S. Spray-drying as a method for microparticulate controlled release systems preparation: Advantages and limits. I. Water-soluble drugs. Drug Development and Industrial Pharmacy, 2001, 27(3), 195-204.
16. Neill M.G., Shahani R., Zlotta A.R. Tamsulosin oral controlled absorption system (OCAS) in the treatment of benign prostatic hypertrophy. Ther Clin Risk Manag. 2008, 4(1), 11-18.
17. Schulman C.C., Cortvriend J., Jonas U., Lock T.M., Vaage S., Speakman M.J. Tamsulosin: 3-year long-term efficacy and safety in patients with lower urinary tract symptoms suggestive of benign prostatic obstruction: analysis of a European, multinational, multicenter, open-label study. European Tamsulosin Study Group. Eur Urol. 1999, 36(6), 609-620.
18. Djavan B., Milani S., Davies J., Bolodeok J. The Impact ofTamsulosin Oral Controlled Absorption System(OCAS) on Nocturia and the Quality of Sleep: Preliminary Results of a Pilot Study. European Urology Supplements. 2005;4:61–68. doi:10.1016/j.eursup.2004.12.001
19. Michel M.C., Korstanje C., Krauwinkel W., Shear M., Davies J., Quartel A. Cardiovascular Safety of the Oral Controlled Absorption System (OCAS) Formulation ofTamsulosin Compared to the Modified Release (MR) Formulation. European Urology Supplements. 2005, 4, 53–60.
20. Prasaja B., Harahap Y., Lusthom W., Setiawan E.C., Ginting M.B., Hardiyanti, Lipin. A bioequivalence study of two tamsulosin sustained-release tablets in Indonesian healthy volunteers. Eur J Drug Metab Pharmacokinet. 2011, 36(2), 109-113.
21. Keizers P.H.J., Wiegard A., Venhuis B.J. The quality of sildenafil active substance of illegal source. J Pharm Biomed Anal. 2016, 131, 133-139.
22. Ali I., Gupta V.K., Aboul-Enein H.Y., Singh P., Sharma B. Role of racemization in optically active drugs development. Chirality. 2007, 19(6), 453-463.
23. Trasi N.S., Purohit H.S., Taylor L.S. Evaluation of the Crystallization Tendency of Commercially Available Amorphous Tacrolimus Formulations Exposed to Different Stress Conditions. Pharm Res. 2017, 34(10), 2142-2155.
24. Zidan A.S., Rahman Z., Sayeed V., Raw A., Yu L., Khan M.A. Crystallinity evaluation of tacrolimus solid dispersions by chemometric analysis. Int. J. Pharm. 2012, 423(2), 341-350.
25. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. 2001. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Adv. Drug Deliv. Rev. 46, 3-26.
26. Wang J., Urban L., 2004. The impact of early ADME profiling on drug discovery and development strategy. Drug Discovery World Fall 5, 73-86.
27. Dosio F., Brusa P., Crosasso P., Arpicco S., Cattel L. Preparation, characterization and properties in vitro and in vivo of a paclitaxel-albumin conjugate. J. Control. Release. 1997, 47(3), 293-304.
28. Hawkins M.J., Soon-Shiong P., Desai N. Protein nanoparticles as drug carriers in clinical medicine. Adv Drug Deliv Rev. 2008, 60(8), 876-885.
29. Desai N. Challenges in Development of Nanoparticle-Based Therapeutics. Aaps J. 2012, 14(2), 282-295.