Геморрагический цистит. Новые подходы
 |
Л.А. Синякова Д.м.н., профессор кафедры урологии и хирургической андрологии РМАНПО (г. Москва) |
В программе «Час с ведущим урологом» гостем проекта стала Л.А. Синякова, д.м.н., профессор кафедры урологии и хирургической андрологии РМАНПО. Любовь Александровна подробно рассказала об актуальных методах диагностики и лечения геморрагического цистита в практике уролога.
Г еморрагический цистит — один из видов цистита, главной отличительной особенностью которого является появление примеси крови в моче, определяемой на глаз (макрогематурия) или лабораторно (микрогематурия), и возникающей на фоне дизурических явлений. Гематурия говорит о значительной глубине повреждения многослойного эпителия (уротелия) слизистой оболочки мочевого пузыря, а также распространенности деструктивного процесса на эндотелий капилляров его микроциркуляторного русла. Доля геморрагического цистита в общем числе случаев заболеваемости циститом невелика и составляет, по разным данным, от 5 до 10% [1,2].
Сегодня большинство научных работ по изучению этиологии геморрагического цистита чаще всего включают пациентов с онкологическими заболеваниями органов малого таза и мочевого пузыря. Инфекционная этиология заболевания, как правило, сопряжена с иммуносупрессивным состоянием. В рекомендациях Европейской ассоциации урологов (EAU) по воспалительным заболеваниям нижних мочевых путей геморрагический цистит не представлен вовсе. Тем не менее, возросшее число пациенток молодого возраста с новыми случаями геморрагического цистита без лейкоцитурии и со стерильным посевом мочи требует свежего взгляда на проблему, проведения самого тщательного обследования и, как следствие, пересмотра стандартов обследования и лечения таких пациенток.
Причины макрогематурии
Появление макрогематурии может быть вызвано несколькими причинами. В частности, она возникает у пациенток, принимающих антикоагулянты или дезагреганты, при передозировке указанных препаратов. Вторая наиболее частая причина — наличие хронической герпесвирусной инфекции, при этом отсутствует лейкоцитурия и бактериурия, развивается уретрит и цистит вирусной этиологии. Бактериальный цистит также может сопровождаться макрогематурией, более характерно наличие терминальной гематурии. Самой серьезной и опасной причиной гематурии может являться наличие опухоли мочевого пузыря, когда острый или рецидивирующий цистит — только сопутствующее заболевание.
Этиология геморрагического цистита
В последнее время, как отметила Любовь Александровна, меняется этиология рецидивирующих инфекций нижних мочевых путей (РИНМП). Основным возбудителем, как и раньше, остается E. сoli, однако такие возбудители, как вирусы (ВПГ 1 и 2 типа, ЦМВ, ВПЧ, вирус Эпштейна — Барр), а также Corinenacterium urealiticum вносят значительный вклад в развитие ИНМП. При отсутствии эффекта от проводимой терапии целесообразно и показано проведение более тщательного обследования для исключения инфекций, передающихся половым путем (ИППП), и вирусных инфекций. Особенно это актуально для женщин, планирующих беременность, во избежание внутриутробного заражения плода. Выполнение цистоскопии также рекомендуется не в исключительных случаях, а при наличии макрогематурии и неэффективности лечения.
Наличие возбудителей урогенитальных инфекций, включая вирус герпеса и ВПЧ, по данным ряда исследований, выявляется у пациенток с циститом и пиелонефритом более чем в 70% случаев.
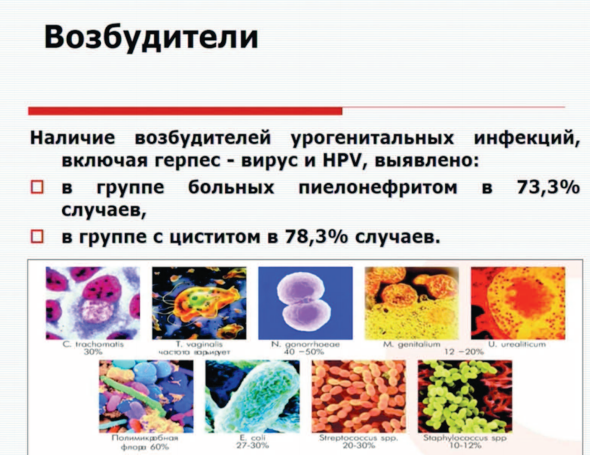
При наличии инфекции мочевых путей генитальным герпесом дизурия возникает в 58% случаев, цистит — в 47%, поражение шейки матки — в 88%. Также в 1% случаев наблюдаются глазные инфекции. Уровень распространенности герпеса достаточно высок: например, в США сейчас зарегистрировано 40 млн больных, к которым ежегодно добавляется порядка 599 тыс. новых случаев. Риск заражения женщины при контакте с инфицированным мужчиной составляет 80–90% из-за высокой концентрации вируса в семенной жидкости. Для мужчины риск заражения от инфицированной партнерши — порядка 50%. Важно, что при первой атаке генитального герпеса у матери риск заражения плода достигает 50%, при рецидиве — 5%.
Этиология геморрагического цистита может быть инфекционной (бактериальная или вирусная инфекции) или неинфекционной (лучевая или химиотерапия). Доля геморрагического цистита в общем случае заболеваемости циститом невелика и составляет всего 5–10%, однако данная форма является наиболее опасной и требует экстренной госпитализации в урологический стационар для исключения онкологических заболеваний органов мочевой и репродуктивной систем, а также мочекаменной болезни. Дети и пациенты с ослабленным иммунитетом особо предрасположены к развитию вирусного геморрагического цистита. Его вызывают, в частности, полиомавирус человека, аденовирус 7, 11, 34 и 35 типов, цитомегаловирус, вирус простого герпеса 1 и 2 типов. Полиомавирус часто встречается у детей и бессимптомно локализуется в почках и других органах. Когда иммунная система скомпрометирована, вирус реактивируется, что может приводить к развитию геморрагического цистита.
Лучевая терапия — наиболее частая причина неинфекционного геморрагического цистита у пациентов со злокачественными образованными органов малого таза. По данным разных авторов, это осложнение возникает у 5–25% пациентов [3,4,5]. Одним из эффективных методов в данном случае является лечение в барокамере.
Наиболее частыми бактериальными возбудителями цистита, в том числе геморрагического, являются E. сoli (70–95% случаев) и Staphylococcus saprophytics в 5–10%. Реже выделяются другие представители семейства энтеробактерий: Proteus mirabilis и Klebsiella sp. [6].
ВПГ 1 и 2 типа ассоциированы с развитием геморрагического цистита у иммунокомпрометированных пациентов, в том числе получавших иммунодепрессанты после трансплантации органов или больных ВИЧ-инфекцией [7,8]. Описаны также клинические случаи развития геморрагического цистита у иммуностабильных пациентов, инфицированных генитальным герпесом [9]. Следует отметить, что вирус простого герпеса обладает тропностью к мочеполовой системе. Экспериментально доказано, что клетки эпителия мочевого пузыря чувствительны к ВПГ 2 типа.
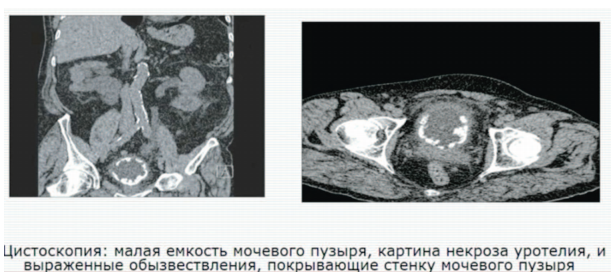
Практически всегда герпетический цистит сопровождается герпетическим уретритом, при котором наблюдаются рези и жжение в уретре, гиперемия и отечность губок уретры, а также скудное слизистое отделяемое. Для клинической картины герпетического цистита характерны боли в конце мочеиспускания и гематурия, при цистоскопии наблюдаются единичные эрозии.
Инкрустирующий цистит
Форма заболевания, чаще встречающаяся у мужчин, — инкрустирующий цистит (ИЦ). Это хроническое воспаление мочевого пузыря, сопровождающееся солевой инкрустацией его слизистой, вызываемой расщепляющими мочевину бактериями, такими как Corinenacterium unrealiticum группы D2, Nanobacteria, E. coli, Ureaplasma urealyticum и Proteus. Первый случай инкрустирующего цистита был описан в 1914 г. французским урологом J. Francois как тяжелое локализованное воспаление с фосфатно-известковыми отложениями.
К факторам риска инкрустирующего цистита относятся:
- хирургические вмешательства (ТУР);
- иммуносупрессивные состояния;
- травматические повреждения мочевого пузыря;
- пожилой возраст;
- лучевая терапия;
- митомицин С.
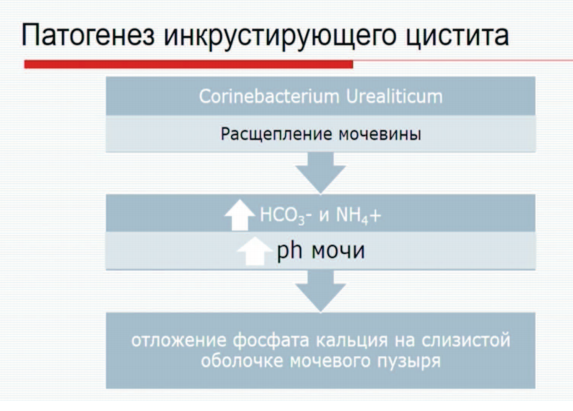
В присутствии Corinebacterium urealiticum происходит расщепление мочевины с резким повышением pH мочи, что приводит к отложению фосфата кальция на слизистой оболочке мочевого пузыря и последующему развитию инкрустирующего цистита.
Больным инкрустирующим циститом показана антибактериальная терапия с учетом чувствительности выделенных при посеве мочи микроорганизмов (гликопептиды, фторхинолоны, полусинтетические пенициллины), а также инстилляции кислыми растворами ренацидина (лимонно-кислотная смесь), ацетогидроксаминовой и борной кислоты. В ряде случаев может выполняться ТУР зоны инкрустированной стенки мочевого пузыря, причем важно минимальное использование электрокоагуляции с целью сохранения васкуляризации тканей.
Клиническая картина
Клиническая картина геморрагического цистита характеризуется резко болезненным учащенным мочеиспусканием малыми порциями, императивными позывами и гематурией. Зачастую именно выраженные боли и выраженная гематурия, иногда со сгустками, а также неэффективность назначенной антимикробной терапии являются причиной госпитализации в стационар. Больных длительное время беспокоят дискомфорт и жжение в уретре, диспареуния и отсутствие либидо.

Клинический пример №1 пациентки 50 лет, которая была госпитализирована в урологическое отделение московской ГКБ им. В. П. Демихова с картиной геморрагического цистита. Заболевание возникло после перенесенного стресса (пациентка потеряла работу и пережила развод). После стабилизации состояния и купирования макрогематурии выполнена смотровая цистоскопия, при которой определялась выраженная инъекция слизистой сосудами, выше правого устья визуализировалось папиллярное образование около 5 мм в диаметре. Выполнена ТУР стенки мочевого пузыря с опухолью. При гистологическом исследовании выявлена очаговая дисплазия уротелия, выраженная инфильтрация лимфоцитами с очаговой гиперплазией по типу формирования лимфоидного фолликула. Также при обследовании у пациентки выявлено наличие хронической герпесвирусной инфекции, цитомегаловируса и вируса Эпштейна-Барр.
Таким образом можно убедиться, что наличие латентной вирусной инфекции, особенно сочетанной, способствует развитию диспластических процессов уротелия, поэтому частую реактивацию вирусной инфекции следует рассматривать как фактор риска развития диспластических процессов мочевого пузыря.
Опыт урологического отделения ГКБ им. Боткина
У больных с наличием вирусной инфекции мочевых путей на фоне нарушенного иммунитета и дисбиотических процессов во влагалище и кишечнике, ассоциированных с неоднократными, часто необоснованными курсами антибактериальной терапии, присоединяется неспецифическая бактериальная инфекция. Появляется диагноз хронического цистита, и вновь назначается антимикробная терапия, что усугубляет клинические проявления заболевания и не устраняет этиологический фактор.
За период с 2017 по апрель 2019 года в клинику урологии ГКБ им. Боткина обратилось 295 больных ИНМП, включая тех, кто был госпитализирован по скорой медицинской помощи. Среди госпитализированных пациентов 15 мужчин с инкрустирующим циститом, в основном после ТУР предстательной железы, и молодые женщины с впервые возникшим геморрагическим циститом, у которых отсутствовала или была минимальной лейкоцитурия, а также пациентки старшей возрастной группы, принимавшие антикоагулянты или дезагреганты. У последних клиническая картина цистита включала в себя макрогематурию.
Причинами обращения пациенток в амбулаторном порядке были неэффективность лечения, сохранение симптомов заболевания, частые рецидивы, а также выявление при цистоскопии изменений, характерных для лейкоплазии мочевого пузыря. Всем больным выполнялся посев мочи. При наличии макрогематурии — анализ мочи на атипические клетки, УЗИ почек и мочевого пузыря, а также цистоскопия. Обследование на наличие или носительство вирусных инфекций (ИФА, ПЦР) было рекомендовано в амбулаторных условиях с последующей консультацией в клинике.
Больным геморрагическим циститом,госпитализированным в клинику, назначалась антибактериальная терапия. После купирования дизурии, в случае сохранения гематурии выполнялись УЗИ и цистоскопия, при этом у одной пациентки была выявлена папиллярная опухоль лоханки, а еще в двух случаях обнаружена опухоль мочевого пузыря. У больных геморрагическим циститом в подавляющем большинстве случаев посев мочи был стерилен. Дальнейшее обследование 76 пациенток позволило выявить наличие хронической латентной герпесвирусной инфекции (ВПГ 1 и 2 типа, ЦМВ, вирус Эпштейна — Барр, чаще всего в различных сочетаниях), что подтверждалось данными анамнеза и результатами обследования половых партнеров. Этим пациенткам назначалась противовирусная терапия.
Клинические рекомендации EAU и алгоритм РМАНПО
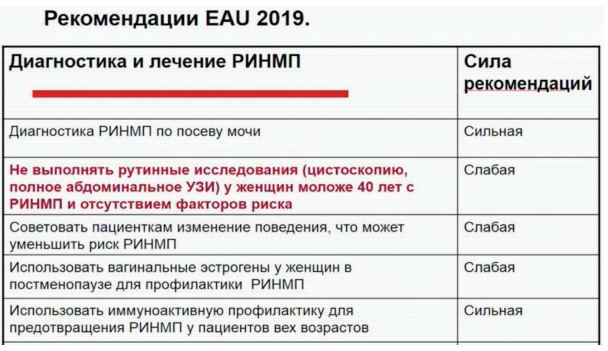
Клинические рекомендации Европейской ассоциации урологов (ЕАУ) 2019 года предписывают не выполнять рутинные исследования (цистоскопию, полное абдоминальное УЗИ) у женщин моложе 40 лет с РИНМП и отсутствием факторов риска, однако сила рекомендации в данном случае слабая. С точки зрения профессора, при наличии стойкой дизурии, особенно в сочетании макрогематурией, пациентка нуждается в тщательном обследовании.
На кафедре урологии и хирургической андрологии РМАПО разработан алгоритм обследования пациенток со стойкой дизурией, в основе которого лежит анализ жалоб большой. Необходимо выявление таких факторов риска, как раннее начало половой жизни, частая смена половых партнеров, наличие инвазивных манипуляций, сопутствующие хронические гинекологические заболевания, вирусные инфекции и дисбиозы влагалища. Также выполняется общий анализ мочи и посев на флору и чувствительность к антибиотикам, проводится влагалищный осмотр. Ультразвуковое исследование должно выполняться комплексно, включая УЗИ почек, мочевого пузыря (с определением остаточной мочи), матки и придатков, а также допплерографию сосудов малого таза. Если симптомы у женщины сохраняются более года, проводится цистоскопия с биопсией. Также принципиально важным является посев отделяемого из влагалища на флору и чувствительность к антибиотикам с количественным определением лактобактерий (Фемофлор).
Лечебная тактика при ГЦ
По рекомендациям ЕАУ, для лечения неосложненного цистита применяются фосфомицина трометамол, нитрофурантоин и пивмециллинам. Альтернативой являются цефалоспорины, однако, как отметила Любовь Александровна, их лучше беречь для лечения беременных и пациенток с инфекциями верхних мочевых путей.
В связи с тяжелыми инвалидизирующими, потенциально необратимыми побочными действиями хинолонов/фторхинолонов Комитет по оценке рисков лекарственных средств Фармаконадзора Европейского медицинского агентства вынес решение от 11 марта 2019 года о приостановке разрешения на торговлю препаратами, содержащими циноксацин, флюмеквин, налидиксовую и пипемидовую кислоту. Рекомендовано ограничить использование остальных фторхинолонов и советовать пациентам прекратить лечение ими при первых признаках нежелательных побочных реакций, действующих на мышцы, сухожилия, суставы и нервную систему (тендиниты и разрывы сухожилий, артралгия или боль в ногах, отеки или боли в суставах, нарушения походки, нейропатии, связанные с парестезиями, усталость, депрессия, проблемы с памятью, засыпанием, зрением и слухом, а также изменение вкуса). Важно, что эти явления могут проявить себя как через 2 месяца после начала лечения фторхинолонами, так и через несколько месяцев после прекращения лечения.
Не рекомендуется назначать фторхинолоны при небактериальной инфекции, например, при абактериальном (хроническом) простатите или рецидивирующем цистите. В целом рекомендовано не применять препараты этого ряда для лечения инфекционных заболеваний легкой или средней степени тяжести, пока другие рекомендуемые антибактериальные препараты не применялись. Также их применения следует избегать у пациентов с серьезными побочными эффектами в анамнезе, у пожилых людей, у пациентов с хронической болезнью почек или пересаженными органами. Кроме того, нужно избегать комбинации фторхинолонов и кортикостероидов. При неосложненном цистите фторхинолоны назначаются только в случае отсутствия альтернативы. Пефлоксацин решением европейского комитета отменен во всех показаниях. Вместе с тем комиссия заключила, что для пациентов с серьезными инфекциями, чувствительными к фторхинолонам, они остаются важными препаратами выбора, несмотря на редкий риск длительно действующих, инвалидизирующих и потенциально необратимых нежелательных побочных реакций.
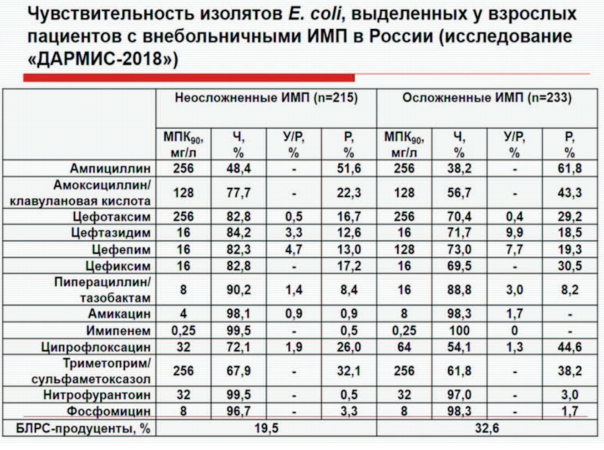
Согласно результатам российского исследования чувствительности изолятов E. coli, выделяемых у взрослых пациентов с внебольничными ИМП (ДАРМИС2018), препаратом выбора для лечения таких больных остается фосфомицин. Из препаратов нитрофуранового ряда показано и целесообразно применение фуразидина калиевой соли и магния карбоната в соотношении 1:1. Препарат характеризуется высокой биодоступностью, быстро и хорошо всасывается в желудочнокишечном тракте и не оказывает действия на сапрофитную флору. Токсичность его в 8,3 раза ниже, чем у фурадонина. Препарат назначается по 100 мг 3 раза в сутки на 7 дней. Также может применяться препарат с МНН Фуразидин – он всасывается в тонкой кишке, и его концентрация в моче значительно выше, чем в крови. Не изменяет pH мочи, в отличие от нитрофурантоина. Не содержит лактозы в составе, что минимизирует риск его непереносимости и повышает приверженность лечению. Назначается по 100–200 мг 2–3 раза в день. Курс лечения составляет 7–10 дней.
В России также зарегистрирован представитель класса нитрофуранов нифурател. Кроме основных уропатогенов, нифурател активен в отношении возбудителей вагинальных инфекций: грибов рода Candida, Gardnerella vaginalis, Trichomonas vaginalis и других. Препарат показан для лечения инфекций мочевых путей и вульвовагинитов. Данные мета-анализа в лечении инфекционных вульвовагинитов продемонстрировали высокую его эффективность в отношении смешанных инфекций. Также важно, что нифурател не оказывает влияния на лактобактерии. Возможно его применение при беременности. Рекомендованная суточная доза нифуратела при ИНМП — 600–1200 мг, разделенные на 2–3 приема. Назначается на 5–7 дней. Может применяться в форме вагинальных капсул или вагинального крема в сочетании с нистатином.
Сохранение микробиома
Важно отметить, что наблюдается четкая зависимость между использованием антибиотиков и развитием устойчивости флоры [10]. В последние годы научное сообщество приходит к пониманию важности внутренней экосистемы человека — микробиома. В частности, все большее внимание уделяется тому факту, что частое применение антибиотиков приводит к нарушению видового состава микробиома, что способствует развитию таких заболеваний, как ожирение, мочекаменная болезнь, аллергии, злокачественные новообразования и. т. д. [11; 12; 13]. Этим обоснована необходимость в поиске альтернативных методов лечения неинфекционных ИНМП. к примеру, возможно использование фитопрепаратов, таких как Канефрон Н, основными компонентами которого являются золототысячник, любисток и розмарин. Активные компоненты — фенольные гликозиды и фенолкарбоновые кислоты, фталиды, эфирные масла и флавоноиды. В открытом нерандомизированном многоцентровом пилотном исследовании, соответствующем надлежащей клинической практике, с участием 125 пациенток с клиническими симптомами острого цистита изучалась эффективность применения препарата Канефрон Н в дозировке 2 драже 3 раза в сутки 7 дней [14]. Лечение Канефроном привело к клиническому выздоровлению 71,2% пациенток на 7 дней и 85,6% — на 37 день. При этом только 3,4% (3 пациентки) получали антибактериальную терапию в течение первой недели.
Также проводились исследования по изучению тератогенного действия Канефрона Н в соответствии с Надлежащей лабораторной практикой. Животные получали препарат внутрь в дозах до 1250 мг/кг массы тела, что в 100 раз превышает максимально рекомендуемую терапевтическую дозу для человека. Результаты исследований продемонстрировали, что Канефрон Н не оказал ни тератогенного, ни фетотоксического действия ни у крыс, ни у кроликов [15]. Безопасность Канефрона продемонстрирована в 19 клинических исследованиях. Всего его получали 444 ребенка, 2270 беременных женщин, 1170 мужчин и небеременных женщин, также наблюдались 1762 ребенка, родившихся у матерей, принимавших Канефрон во время беременности. Длительность приема препарата составляла от 1 недели до 6 месяцев. В большинстве исследований подробно описаны безопасность и переносимость терапии Канефроном Н. Сообщения о нежелательных явлениях отсутствовали, исключение составил только один случай кожной сыпи у ребенка с отягощенным аллергическим анамнезом [16].
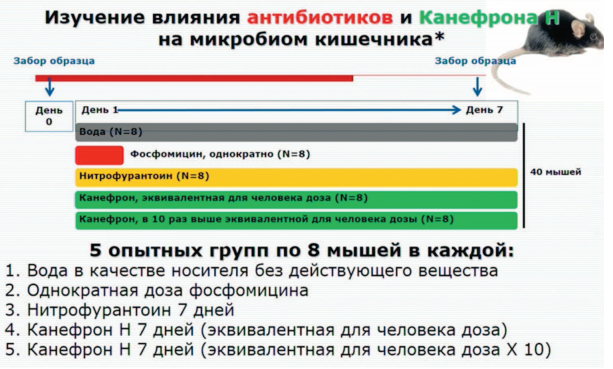
Кроме того, проводилось изучение влияния антибиотиков и Канефрона на микробом кишечника [17]. В ходе исследования было выбрано 5 опытных групп по 8 мышей в каждой. Они получали:
- Воду в качестве носителя без действующего вещества.
- Однократную дозу фосфомицина.
- Нитрофурантоин 7 дней.
- Канефрон Н 7 дней в эквивалентной дозе для человека.
- Канефрон Н 7 дней в эквивалентной дозе для человека х 10.
В кале мышей группы Канефрона было обнаружено альфа-разнообразие (показатель биоразнообразия бактерий, уровень которого соответствовал уровню мышей, получавших только воду). При введении Канефрона в дозе, в 10 раз превышавшей эквивалентную дозу для человека, также отсутствовало негативное влияние на микробиом.
В заключение Любовь Александровна еще раз подчеркнула, что у больных с нарушением мочеиспускания принципиально важным является не просто выбор антибактериального препарата, а обследование, направленное на выяснение причин нарушенного мочеиспускания. При наличии макрогематурии после купирования острых воспалительных проявлений цистита пациенткам показано выполнение цистоскопии. Если достоверно установлен диагноз острого или рецидивирующего цистита, необходимо следовать рекомендациям, имеющим доказательную базу.
Источники:
- Haldar S. et al., Am J Clin Exp Urol, 2014
- Manikandan R. et al., Indian J Urol, 2010
- Basler J. et al., Medscape, 2016
- Crew J. P. et al., Eur Urol, 2001
- Chong K. T. et al., Urology, 2005
- Naber K. G., Urogen Inf, 2010
- Spach D. H. et al., Clin Infect Dis, 1993
- Tutuncuoglu S. O., et al., Bone Marrow Transplant, 2005
- Uuksula A., Infect Dis, 2004
- Costelloe et al., BMJ, 2010
- Костюкевич О. И., Человек и лекарство, 2011
- Ley R. E., Nature, 2006
- Siener R. et al., Kidney Int, 2013
- Naber K. G. et al., 2013
- Sterner, Korn, IBR Forschungs GmbH, 1986
- Набер К. Г.., Перепанова Т. С., РМЖ, 2012
- Gessner A., Annual EAU Congress, 2016
Материал подготовила В.А. Шадеркина
Статья опубликована в журнале Дайджест урологии №5-2019