Пектопексия как способ коррекции апикального пролапса гениталий
В.Б. Филимонов1,2,3, Р.В. Васин1,2,3, И.В. Васина2,3
1 Кафедра урологии с курсом хирургических болезней ФГБОУ ВО РязГМУ Минздрава России, 390026 г. Рязань, ул. Высоковольтная, д. 9.
2 Государственное бюджетное учреждение Рязанской области «Городская клиническая больница № 11», 390037, г. Рязань, ул. Новоселов, д. 26/17.
3 Рязанский областной «Центр урогинекологии и нефрологии», 390037, г. Рязань, ул. Новоселов, д. 26/17.
Пролапс гениталий урогинекологическое заболевание, встречающееся у 11,4–41%женщин [1,2]. ПГ является важной социальной проблемой, так как до 47% этих пациенток имеют трудоспособный возраст и многие отмечают значительное снижение качества жизни [3].
Пролапс гениталий (ПГ) – распространенное Апикальный пролапс гениталий (пролапс среднего отдела) включает в себя смещение вниз матки или шейки матки, а также купола влагалища (после ранее перенесенной гистерэктомии), связанный с повреждением маточно-крестцовых и кардинальных связок [4]. Адекватная поддержка апикальной части имеет важное значение в лечение ПГ, в том числе и при коррекции переднего и заднего отделов тазового дна у женщин [5,6].
Многочисленные исследования показали, что сакрокольпопексия с использованием сетчатого имплантата, фиксируемого к продольным связкам крестца, представляет собой наиболее эффективный вариант устранения апикального пролапса. Данный способ обеспечивает хорошие результаты (эффективность – 78-100%), с сохранением достаточной длины влагалища, восстановлением физиологической оси влагалища и половой функции [4,5,7]. Недостатками сакрокольпопексии являются – большая длительность операции, риск интраоперационного ранения пресакральных сосудов с кровотечением, нарушение дефекации и стрессовое недержание мочи [8].По данным различных авторов около 8-15% пациентов после сакрокольпопексии были повторно оперированы [9,10]. Нарушение дефекации встречается у 0,1-5% пациентов после сакрокольпопексии и связано с уменьшением пространства в малом тазу сеткой, помещенной между крестцом и влагалищем (шейкой матки), спаечным процессом и повреждением нижнего гипогастрального нервного сплетения [7,8,11].
Недостатки операции сакрокольпопексии привели к поиску и разработке новых способов коррекции апикального ПГ. В 2011 г. C. Banerjee, K.G. Noe´ впервые представили результаты оперативного лечения апикальной формы ПГ с помощью нового способа – пектопексии, разработанного для пациенток с ожирением. В этом методе апикальный ПГ устраняется с помощью фиксации опущенных структур сеткой к куперовской связке (ligamentum iliopectineale) с обеих сторон. Сетка повторяет естественные структуры – круглые и широкие связки матки, восстанавливая утраченный подвешивающий связочный аппарат, и не вступает в конфликт с мочеточниками и кишечником [12].
В зарубежной литературе пектопексия лапароскопическим доступом представлена в качестве альтернативного метода лечения апикального ПГ, особенно у пациенток с заведомо трудным и сложным выделением промонториума при сакрокольпопексии [12,13,14]. В отечественной литературе по данным доступных источников информации нет работ посвященных пектопексии.
Все вышеизложенное и определило цель исследования – оценить результаты пектопексии при апикальном пролапсе гениталий.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В период 2016–2018 гг. на клинической базе ФГБОУ ВО РязГМУ Минздрава России обследованы и прооперированы методом пектопексии 26 женщин с ПГ II–IV стадии по классификации POP-Q, ICS (1996).Все операции были стандартизированы и выполнены одной хирургической бригадой.
Согласно цели исследования, критериями включения в исследование стали возраст женщин старше 18 лет, симптоматический изолированный апикальный ПГ или апикальный ПГ в сочетании с передним или задним ПГ II–IV стадии по классификации POP-Q, согласие пациенток на оперативное лечение и участие в данном исследовании. Критериями исключения были беременность, облучение малого таза в анамнезе, тяжелые сопутствующие соматические заболевания, являющиеся абсолютным противопоказанием к оперативному лечению, острые воспалительные процессы органов малого таза, злокачественные и предраковые заболевания гениталий, невозможность наблюдать пациентку в течение 12 месяцев после операции, поливалентная аллергия в связи с риском развития реакции отторжения полипропиленового имплантата.
Всем пациенткам в предоперационном периоде для установления диагноза и показаний к оперативному вмешательству было проведено комплексное клиническое, лабораторное и инструментальное обследование. Клиническое обследование включало сбор анамнеза, общий осмотр пациентки с оценкой эндокринной, нервной, сердечно-сосудистой, дыхательной, пищеварительной, мочевыделительной и половой систем. При гинекологическом исследовании оценку степени пролапса проводили в покое и при натуживании с определением ведущей точки пролапса по классификации POP-Q. Всем пациенткам производилось ультразвуковое исследование (УЗИ) органов малого таза, мочевыделительной системы и промежности.
Результаты оперативного лечения были оценены по следующим параметрам: длительность операции; интраоперационные осложнения; осложнения в раннем и позднем послеоперационном периоде; функциональные и анатомические результаты в отдаленном периоде. Эффективность хирургического лечения оценивали путем комплексного клинико-лабораторного и инструментального обследования.
Отдаленные результаты оперативного вмешательства были прослежены у пациенток в сроки от 1 до 3 лет. Контрольное обследование пациенток проводили в сроки 1, 3, 6 и 12 месяцев после операции, затем ежегодно. Под анатомическим (объективным) рецидивом ПГ понимали появление пролапса II и последующих стадий по классификации POP-Q.
Статистическую обработку массива данных проводили на персональном компьютере с помощью электронных таблиц «Microsoft Excel» и пакета прикладных программ «Statisticafor Windows» v.7.0, Stat SoInc. (США). Рассчитывали следующие показатели: среднее арифметическое (М); стандартное отклонение (СО); коэффициент вариации; асимметрию и эксцесс с оценкой их репрезентативности по t-критерию Стьюдента; степень вероятности возможной ошибки (p). При оценке существенности различий между средними величинами вычисляли коэффициент достоверности по критериям Стьюдента. За уровень достоверности была принята вероятность различия 95,0% (p≤0,05). Для выявления доли факториального и случайного влияния проводили дисперсионный анализ полученных результатов.
Описание операции. Операция выполняется под эндотрахеальным наркозом. Проводится периоперационная антибиотикопрофилактика и профилактика венозных тромбоэмболических осложнений. Пациентка укладывается на операционном столе на спину с максимально разведенными ногами, согнутыми в коленных суставах, с приданием положения Тренделенбурга 30˚–45˚ для смещения из полости малого таза петель тонкого кишечника. В полость мочевого пузыря устанавливается уретральный катетер Фолея № 16-20 по Ch. Обрабатывается операционное поле (передняя брюшная стенка, наружные половые органы и влагалище). Оперирующий хирург становится слева от пациентки, первый ассистент управляет лапароскопом и стоит справа от пациентки, второй ассистент стоит между ног пациентки и управляет маточным манипулятором.
Через параумбиликальный прокол иглой Вереша накладывается пневмоперитонеум и вводится 10 мм троакар с 30° лапароскопом. Устанавливаются один 12 мм (по средней линии живота ниже пупка) и два 5 мм троакара (в правой и левой подвздошных областях), при необходимости во влагалище устанавливается маточный манипулятор. Проводится обзорная лапароскопия, визуализируется матка или шейка матки/культя влагалища (при ранее перенесенной гистерэктомии/ экстирпации матки). Вскрывается брюшина в области пузырно-маточной складки и вдоль круглых связок матки к подвздошно-обтураторной области справа и слева. Визуализируются анатомические ориентиры с обеих сторон – подвздошные сосуды (вена и артерия), запирательный нерв, связка Купера (ligamentum iliopectineale) (рис. 1). В брюшную полость заводится полипропиленовая сетка (поверхностная плотность 40-60 г/м2) размерами 20 см на 2 см. Середина имплантата фиксируется узловыми швам нерассасывающимся шовным материалом (например, пролен 2/0, монофил 2/0, PDS) к шейке матки (или культе влагалища при отсутствии шейки матки). Дистальные части полипропиленовой сетки фиксируются к связке Купера с помощью герниостеплера или отдельными швами нерассасывающимся шовным материалом справа и слева с незначительным натяжением. Таким образом, создается фиксация шейки матки и/или влагалища полипропиленовой сеткой к связкам Купера в виде «гамака». Производится перитонизация сетки непрерывным швом рассасывающейся нитью. Накладываются швы на троакарные раны.
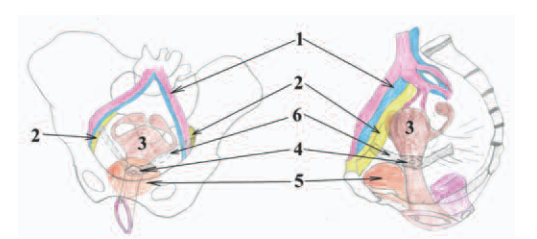
Рис. 1. Схематическое изображение пектопексии. 1 – подвздошные сосуды (вена и артерия), 2 связка Купера (ligamentum iliopectineale), 3 – матка, 4 – шейка матки, 5 – мочевой пузырь, 6 – сетчатый полипропиленовый имплантат
Fig. 1. Schematic representation of pectopexy. 1 iliac vessels (vein and artery), 2 Cooper ligament (ligamentum iliopectineale), 3 uterus, 4 cervix, 5 bladder, 6 mesh polypropylene implant
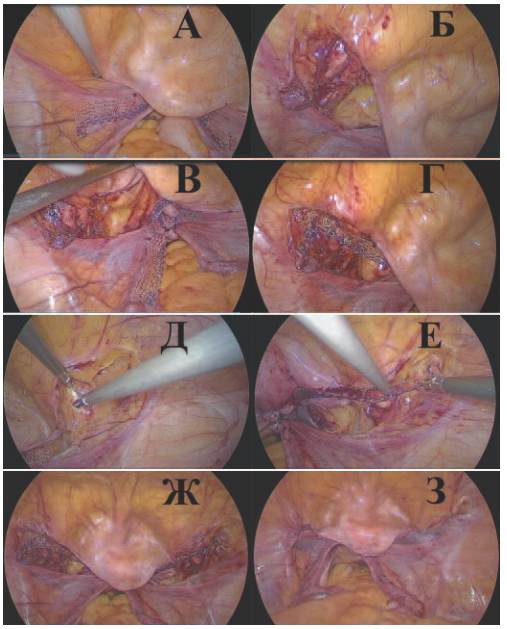
Рис. 1. Этапы операции пектопексии: А – в брюшную полость заведен полипропиленовым имплантат; Б – вскрыта брюшина в подвздошно-обтураторной области слева, визуализируется связка Купера (ligamentum iliopectineale); В – вскрыта брюшина в области пузырно-маточной складки и вдоль круглых связок матки и подвздошно-обтураторной области слева, визуализируются анатомические ориентиры подвздошные сосуды (вена и артерия) справа, связка Купера (ligamentum iliopectineale); Г – левая дистальная часть полипропиленовой сетки фиксирована герниостеплером к связке Купера; Д – вскрыта брюшина в области пузырно-маточной складки и вдоль круглых связок матки и подвздошно-обтураторной области справа; Е правая дистальная часть полипропиленовой сетки фиксирована герниостеплером к связке Купера; Ж – купол влагалища фиксирован полипропиленовой сеткой к связкам Купера в виде «гамака»; З – перитонизация сетки непрерывным швом рассасывающейся нитью
Fig. 1. Stages of pectopexy surgery: A a polypropylene implant is inserted into the abdominal cavity; B the peritoneum was opened in the iliac-obstructive region on the left, the Cooper ligament (ligamentum iliopectineale) is visualized; C the peritoneum was opened in the vesicle-uterine fold and along the round ligaments of the uterus and the iliac-obstructive region on the left, anatomical landmarks of the iliac vessels (vein and artery) on the right, Cooper’s ligament (ligamentum iliopectineale) were visualized; G the left distal part of the polypropylene mesh is fixed by a herniostapler to the Cooper ligament; D the peritoneum was opened in the area of the vesicoureteral fold and along the round ligaments of the uterus and the iliac-obturator region on the right; E the right distal part of the polypropylene mesh is fixed by a herniostapler to the Cooper ligament; G the dome of the vagina is fixed with a polypropylene mesh to the Cooper ligaments in the form of a «hammock»; Z peritonization of the mesh with a continuous seam of absorbable thread
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе исследования установлено, что возраст пациенток варьировал от 47 до 65 лет. Жалобы пациенток с ПГ отражали степень вовлечения в процесс органов малого таза. Наиболее распространенной была жалоба на дискомфорт и ощущение инородного тела во влагалище, которая констатирована у 25 (96,2%) пациенток. Также часто встречались жалобы, связанные с нарушением мочеиспускания: учащенное мочеиспускание — 10 (38,5%), чувство неполного опорожнения мочевого пузыря — 6 (23,1%), стрессовое и ургентное недержание мочи — 4 (15,4%) и 2 (7,7%), соответственно. Основные характеристики пациенток и анамнестические данные отражены в таблице 1
Таблица 1. Характеристика пациентов
Table 1. Patient characteristics
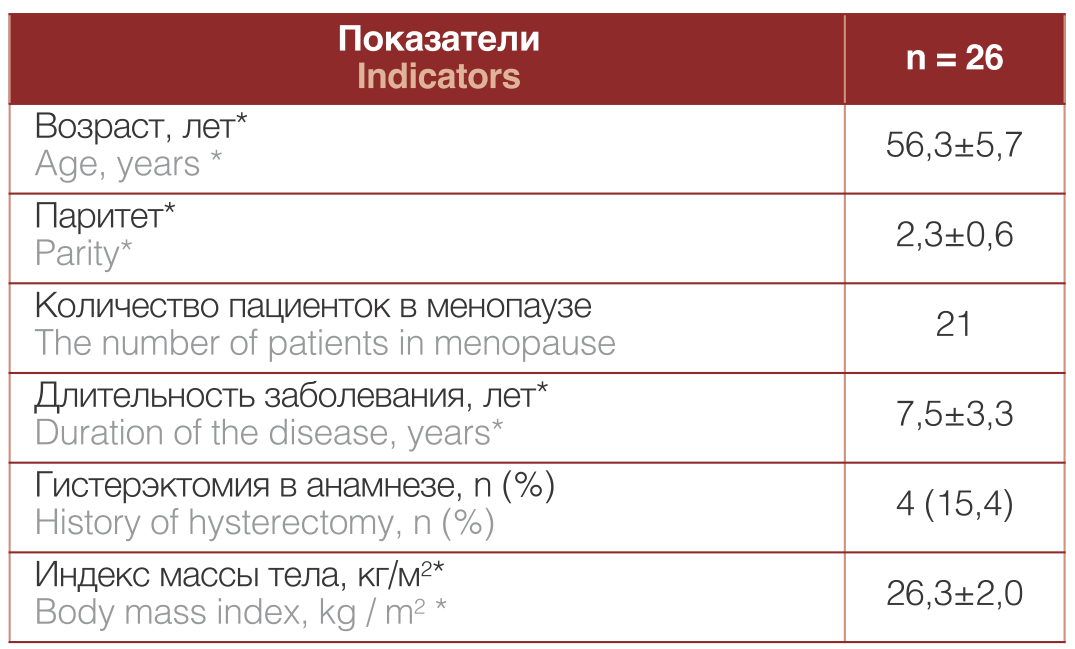
Примечание: *М±СО
Note: * М±СО
Четыре женщины имели в анамнезе гистерэктомию. У 24 (92,3%) пациенток в анамнезе отмечено двое и более родов. У большинства пациенток течение ПГ сопровождалось сопутствующими экстрагенитальными заболеваниями.
При оперативном лечении апикального ПГ способом пектопексии по показаниям проводили одномоментную коррекцию переднего, заднего отделов тазового дна собственными тканями, трансобтураторную уретропексию полипропиленовой сеткой (табл. 2). При элонгации шейки матки выполняли ее ампутацию. Основным показанием к гистерэктомии с овариоэктомией и без во всех случаях было наличие сопутствующих заболеваний матки и придатков: рецидивирующая гиперплазия эндометрия, миома матки более 12 недель, миома матки в сочетании с аденомиозом, доброкачественные новообразования яичников, атипическая гиперплазия эндометрия.
Таблица 2. Симультанно выполненные операции
Table 2. Simultaneously performed surgery

Средняя продолжительность оперативного вмешательства зависела от объема операции и составила 61,7±27,2 минуты (от 40 до 120 минут). Средний объем интраоперационной кровопотери составил 40,4±17,3 мл. Таких интраоперационных осложнений как ранение мочевого пузыря, толстой кишки, мочеточника, n. obturatoris, крупных сосудистых стволов, массивных кровотечений не было. Основные результаты пектопексии представлены в таблице 3
Таблица 3.
Table 3.

Примечание: *М±СО
Note: * М±СО
Использование полипропиленового имплантата при пектопексии не привело к возникновению ассоциированных с сеткой осложнений. Ургентное недержание мочи de novo было нивелировано назначением М –холинолитиков, а пациентке со стрессовой мочевой инконтиненцией de novo была выполнена обтураторная уретропексия полипропиленовой сеткой через 6 месяцев после пектопексии. Нарушений функции прямой кишки в послеоперационном периоде за время наблюдения не зарегистрировано.
Анализ распределения пациенток по стадиям ПГ по системе POP-Q до и после операции показал (табл. 4) улучшение анатомии тазового дна в переднем, заднем и апикальных отделах у большинства пациенток при сохраненной общей длине влагалища. В послеоперационном периоде, через 12 месяцев после операции, рецидив ПГ выявлен у 3 (11,5%) пациенток, при этом рецидивов апикального ПГ не было. В двух наблюдениях рецидив ПГ возник в неоперированном отделе, а в одном случае возникло цистоцеле II степени после выполненной передней кольпоррафии.
Окончательные результаты оперативного лечения ПГ спустя 12 месяцев и более были оценены как хорошие (полное восстановление функциональных изменений и отсутствие рецидива ПГ) у 22 (84,6%) пациенток и удовлетворительные (полное восстановление функциональных изменений, но имелся рецидив ПГ I–II стадии по POP-Q) у 4 (15,4%) пациенток. Неудовлетворительных результатов (сохранение или усугубление стадии тазового пролапса и/или сохранение функциональных изменений) оперативного лечения в исследуемой группе не было.
ОБСУЖДЕНИЕ
В настоящее время среди наиболее распространенных и эффективных (эффективность – 90-96%) методик коррекции апикального ПГ, основанных на восстановлении апикального уровня поддержки (I, по DeLancey), выделяют сакрокольпопексию (открытым и лапароскопическим доступами), крестцово-остистую фиксацию (влагалищным доступом) [4,5,7,15]. Однако данные операции имеют ряд специфических осложнений.
При лапароскопической сакрокольпопексии, в связи с особенностями выполнения операции, существует вероятность повреждения сигмовидной кишки, пресакральных вен и мочеточника [8,13]. Nygaard et al. в своей работе отметил, что частота возникновения кровотечения с выраженной кровопотерей при сакрокольпопексии составляет 4,4% случаев [7]. В сравнении с последней лапароскопическая пектопексия не связана с высоким риском интраоперационных осложнений, так как используется фиксация опущенных структур сеткой к куперовским связкам и при этом сетка располагается вдоль круглых и широких связок, не пересекая мочеточник и кишечник [13,16]. Noe et al. в рандомизированном сравнительном исследовании 83 пациенток с ПГ сравнили результаты лапароскопической пектопексии и сакрокольпопексии. Исследование показало, что среднее время операции и кровопотеря были значительно ниже в группе пектопексии [13]. Наша работа так же подтверждает отсутствие интраоперационных осложнений при проведении лапароскопической пектопексии.
Наиболее частыми осложнениями сакрокольпопексии являются нарушение дефекации и возникновение стрессового недержания мочи de novo, встречающимися в диапазоне 17-37% и 4-50%, соответственно [7,8,11,13]. Расположение сетки при сакрокольпопексии между крестцом и влагалищем (шейкой матки) приводит к уменьшению пространства в тазу и может быть причиной нарушенной дефекации. Кроме того, повреждение нижнего гипогастрального нервного сплетения во время операции сакрокольпопексии, также способствует возникновению нарушений функции кишечника [7,11,17]. В нашем исследовании, как и в ранее опубликованных работах, после лапароскопической пектопексии не наблюдалось развития нарушения дефекации [12,13,14,16]. Возникновение ургентного и стрессового недержания мочи de novo согласно данным различных авторов при лапароскопической сакровагинопекии и пектопексии сопоставимо [6,7,11-17].
Важным и несомненным недостатком лапароскопической сакровагинопексии является длительная кривая обучения этой операции [18].
Выполнение крестцово-остистой фиксации при ПГ сопряжено с риском возникновения рецидива цистоцеле у 20-33% пациенток, что связано со смещением оси влагалища и «открытия» переднего отдела тазового дна [19]. Сакроспинальное прошивание приводит к жесткой фиксации к ней влагалища и девиации его, что проявляется диспареунией в 2-36% случаев [20,21].
На наш взгляд лапароскопическая пектопексия имеет ряд преимуществ: 1) все этапы операции проводятся в широкой области таза; 2) связка Купера является безопасной зоной, так как находится вдали от мочеточника, толстой кишки, пресакральных вен; 3) при этой операции не изменяется физиологическая ось влагалища; 4) фиксация к ligamentum iliopectineale является надежной.
Таблица 4. Распределение пациенток по стадии ПГ по системе POP-Q до и после операции, n (%)
Table 4. Distribution of patients according to the stage of genital prolapse according to the POP-Q system before and after surgery, n (%)
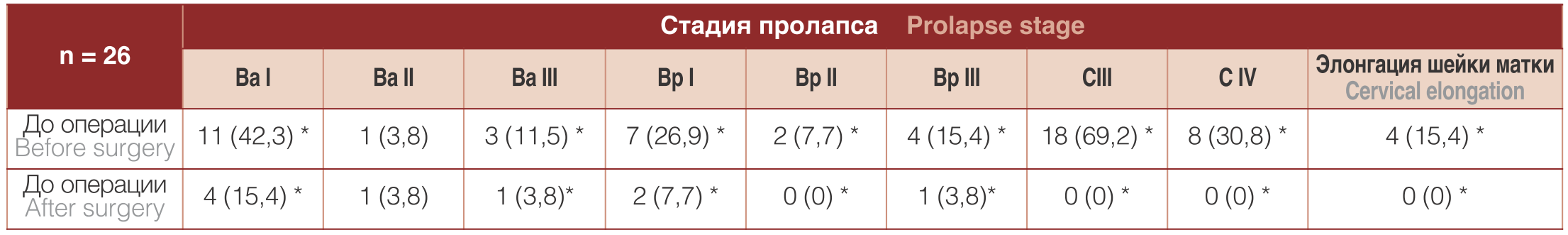
Примечание: *различия достоверны при сравнении до и послеоперационных p≤0,05
Note: * differences are significant when comparing before and postoperative p≤0,05
ВЫВОДЫ
Пектопексия лапароскопическим доступом является безопасным и эффективным способом коррекции апикальной формы генитального пролапса. Однако требуются дальнейшие проспективные сравнительные исследования по изучению этой методики.
ЛИТЕРАТУРА
- I. Nygaard, L. Brubaker, H.M. Zyczynski et al. Long-term outcomes following abdominal sacrocolpopexy for pelvic organ prolapse, JAMA 2013 May 15;309(19):2016-24. doi: 10.1001/jama.2013.4919.
- Alkatout I, Mettler L, Peters G, Noe G, Holthaus B, Jonat W, et al. Laparoscopic hysterectomy and prolapse: a multiprocedural concept. JSLS 2014 Jan-Mar;18(1):89-101. doi: 10.4293/108680813X13693422520846.
- Diagnosis and management of ectopic pregnancy: Greentop Guideline No.21. BJOG 2016; 123(13):e15-e55. doi: 10.1111/1471-0528.14189.
- Beer M, Kuhn A. Surgical techniques for vault prolapse: a review of the literature. Eur J Obstet Gynecol Reprod Biol 2005;119:144-55. doi: 10.1016/j.ejogrb.2004.06.042.
- Maher C, Feiner B, Baessler K, et al. Surgery for women with apical vaginal prolapse. Cochrane Database Syst Rev. 2016 doi.org/10.1002/14651 858.CD012376.
- Barber MD, Maher C. Apical prolapse. Int Urogynecol J 2013 Nov;24(11):1815-33. doi: 10.1007/s00192-013-2172-1.
- Nygaard IE, McCreery R, Brubaker L, Connolly A, Cundiff G, Weber AM, et al. Pelvic Floor Disorders Network. Abdominal sacrocolpopexy: a comprehensive review. Obstet Gynecol 2004;104:805-23. doi: 10.1097/01.AOG.0000139514.90897.07.
- Kumar S, Malhotra N, Chumber S, Gupta P, Aruna J, Roy KK, et al. Control of presacral venous bleeding, using thumbtacks. Arch Gynecol Obstet 2007;276:385-6. doi: 10.1007/s00404-007-0344-2
- Salvatore S, Athanasiou S, Digesu GA, Soligo M, Sotiropoulou M, Serati M, Antsaklis A, Milani R. Identification of risk factors for genital prolapse recurrence. Neurourol Urodyn 2009;.28(4): 301–304. doi: 10.1002/nau.20639.
- Dällenbach P, JungoNancoz C, Eperon I, Dubuisson JB, Boulvain M. Incidence and risk factors for reoperation of surgically treated pelvic organ prolapse. Int Uro-gynecol J 2012; 23(1):35–41. doi: 10.1007/s00192-011-1483-3.
- Sarlos D, Brandner S, Kots L, Gygax N, Schaer G. Laparoscopic sacrocolpopexy for uterine and post-hysterectomy prolapse: anatomical results, quality of life and perioperative outcome a prospective study with 101 cases. Int Urogynecol J Pelvic Floor Dysfunct 2008;19:1415-22. doi: 10.1007/s00192-008-0657-0.
- Banerjee C, Noe´ KG. Laparoscopic pectopexy: A new technique of prolapse surgery for obese patients. Arch Gynecol Obstet 2011;284:631–635. doi: 10.1007/ s00404-010-1687-7.
- Noe KG, Schiermeier S, Alkatout I, Anapolski M. Laparoscopic pectopexy: a prospective, randomized, comparative clinical trial of standard laparoscopic sacral colpocervicopexy with the new laparoscopic pectopexy-postoperative results and intermediate-term follow-up in a pilot study. J Endourol 2015;29:210-5. doi: 10.1089/end.2014.0413.
- Kale A, Biler A, Terzi H, Usta T, Kale E. Laparoscopic pectopexy: initial experience of single center with a new technique for apical prolapse surgery. Int Braz J Urol 2017;43:903-909. doi: 10.1590/S1677-5538.
- N. Meuman, S. Natalia, S. Vladimir, B. Jacob. Anterior needle-guided mesh in advanced pelvic organ prolapse: apical fixation on sacrospinous ligaments. Eur J Obstet Gynecol Reprod Biol 2014 Jan;172:120-3. doi: 10.1016/j.ejogrb.2013.09.045.
- A. Biler, I. E. Ertas, G. Tosun, I. Hortu, U. Turkay, O. E. Gultekin, G. Igci. Perioperative complications and short-term outcomes of abdominal sacrocolpopexy, laparoscopic sacrocolpopexy, and laparoscopic pectopexy for apical prolapse. Int Braz J Urol 2018 SepOct;44(5):996-1004. doi: 10.1590/S1677-5538.
- Akladios CY, Dautun D, Saussine C, Baldauf JJ, Mathelin C, Wattiez A. Laparoscopic sacrocolpopexy for female genital organ prolapse: establishment of a learning curve. Eur J Obstet Gynecol Reprod Biol. 2010 Apr;149(2):218-21. doi: 10.1016/j.ejogrb.2009.12.012.
- S. Manodoro, E. Werbrouck, J. Veldman Review: The laparoscopic approach to pelvic floor surgery. Obstet Gynaecol Forum 2011;21:P2.
- Tseng LH, Chen I, Chang SD, Lee CL. Modern role of sacrospinous ligament fixation for pelvic organ prolapse surgery a systemic review. Taiwan J Obstet Gynecol 2013;52(3):311317 doi.org/10.1016/j.tjog.2012.11.002.
- Mowat A, Wong V, Goh J, et al. A descriptive study on the efficacy and complications of the Capio (Boston Scientific) suturing device for sacrospinous ligament fixation. Aust N Z J Obstet Gynaecol 2018;58(1):119-124. https://doi.org/10.1111/ajo.12720.
- Baumann M, Salvisberg C, Mueller M, Kuhn A. Sexual function after sacrospinous fixation for vaginal vault prolapse: bad or mad? Surg Endosc 2009;23(5):1013-1017. doi.org/10.1007/s00464-008-0108-5.
Статья опубликована в журнале “Экспериментальная и клиническая урология” №4 2019, 139-144