Индекс фрагментации ДНК сперматозоидов – необходимость для современной клинической практики
Е.А. Епанчинцева1, 2, В.Г. Селятицкая1 , В.А. Божедомов3
- 1 ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»; Россия, 630117 Новосибирск, ул. Тимакова, 2;
- 2 ООО «Новосибирский центр репродуктивной медицины» ГК «Мать и дитя»; Россия, 630037 Новосибирск, ул. Героев Революции, 3;
- 3 ФГБОУ «Московский государственный университет им. М.В. Ломоносова»; Россия, 119991 Москва, Ленинские горы, 1 Контакты: Елена Александровна Епанчинцева EpanE@yandex.ru
Введение
В современном мире наряду с увеличением продолжительности и качества жизни растет число бесплодных пар. По данным Европейской ассоциации урологов (European Association of Urology, EAU), у 15 % пар, стремящихся зачать ребенка, беременность не наступает в течение 1 года, что побуждает их обратиться за медицинской помощью [1]. Каждая 8-я пара сталкивается с трудностями при попытке зачать первого ребенка, каждая 6-я пара – при попытке зачать последующего [2]. По данным EAU за 2018 г., в структуре причин супружеского бесплодия доля мужского фактора составляет около 50 % [1]. Помимо ненаступления беременности, важная составляющая комплексной проблемы бесплодия – невынашивание беременности. Согласно данным регистра Российской ассоциации репродукции человека за 2016 г., в Российской Федерации заканчиваются родами на сроке 22 недели и более только 76,3 % беременностей, наступивших в результате применения вспомогательных репродуктивных технологий (ВРТ): экстракорпорального оплодотворения (ЭКО) и интрацитоплазматической инъекции сперматозоида (intracytoplasmic sperm injection, ICSI), а частота родов в расчете на пункцию фолликулов составляет для ЭКО и ICSI соответственно 22,0 и 18,6 % [3].
По современным представлениям, именно фрагментация ДНК сперматозоидов (ФДС) является одной из главных причин прерывания беременности. В руководстве EAU по диагностике и лечению мужского бесплодия указано, что ФДС снижает шансы на зачатие естественным путем и повышает риск невынашивания беременности [1]. Согласно руководству по лечению привычного невынашивания беременности, разработанному Европейским обществом специалистов по репродукции и эмбриологии человека (European Society of Human Reproduction and Embryology), необходимо определять индекс ФДС в ходе обследования пары уже после 1 эпизода самопроизвольного прерывания беременности [4]. Ввиду высокой значимости ФДС в современной репродуктивной медицине лавинообразно увеличивается число публикаций, посвященных этой проблеме. Целью данного обзора стало изложение и краткий анализ ключевых вопросов этиологии, патогенеза и подходов к коррекции ФДС.
Распространенность, этиология и патогенез фрагментации ДНК сперматозоидов
Фрагментация ДНК – наиболее частое нарушение ультраструктуры сперматозоидов, представляющее собой одно- и двухцепочечные разрывы молекулы ДНК, которые обусловлены уменьшением содержания в хромосомах протаминов – специальных белков, защищающих молекулу ДНК от внешних повреждений. ФДС влияет на ранние этапы эмбрионального развития, особенно на формирование бластоцисты, снижая частоту наступления беременности в циклах ЭКО/ICSI [5–8].
По данным метаанализа, проведенного в 2018 г., в который были включены сведения о 2883 бесплодных (средний возраст 35,22 ± 4,31 года) и 1294 фертильных мужчинах (средний возраст 34,24 ± 3,03 года), у фертильных пациентов наблюдалось большее количество сперматозоидов, в том числе подвижных, а у бесплодных мужчин был значительно выше индекс ФДС (р <0,001) [9]. По данным российских исследователей, частота выявления повышенного уровня ФДС составляет около 60 % при стаже бесплодия около 5 лет [10].
К основным механизмам, оказывающим влияние на ФДС, относят апоптоз, нарушение созревания хроматина сперматозоидов и окислительный стресс [11, 12]. Согласно данным этих исследований, повреждение ДНК может происходить на всех этапах созревания сперматозоида (рис. 1). Апоптоз развивается в процессе созревания сперматозоидов в яичке, но он не всегда заканчивается гибелью клеток, поэтому сперматозоиды с апоптотическими признаками могут быть обнаружены в эякуляте [13]. Дефекты созревания хроматина сперматозоидов обусловлены невозможностью репарации тех разрывов ДНК, которые возникают при замене гистонов на протамины во время ремоделирования ядер в сперматидах (см. рис. 1) [14]. Наконец, окислительный стресс возникает, когда продуцируемые активные формы кислорода (АФК) подавляют антиоксидантную защиту [15]. Окислительный стресс, вероятнее всего, является основным механизмом ФДС, действующим во время прохождения сперматозоидов по мужской половой системе, так как эякулированные сперматозоиды демонстрируют более высокие уровни ФДС, чем тестикулярные [16].
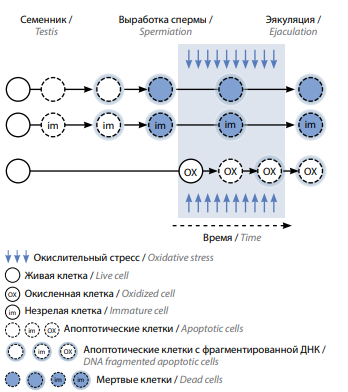
Рис. 1. Патогенез фрагментации ДНК сперматозоидов. Некоторые воздействия, включая нарушение созревания хроматина, могут вызвать апоптоз в зародышевых клетках и в результате этого – фрагментацию и гибель ДНК (строки 1–2). Далее эти клетки проходят по мужским половым путям без дополнительных повреждений. Активные формы кислорода, напротив, атакуют живые клетки, вызывая апоптоз и фрагментацию ДНК (строка 3) (адаптировано из [11])
Fig. 1. Pathogenesis of sperm DNA fragmentation. Some effects, including impaired chromatin maturation, can cause apoptosis in germ cells and thus DNA fragmentation and death (lines 1–2). Further, these cells pass in the male genital tract without additional damage. Conversely, reactive oxygen species attack living cells, leading them to apoptosis and DNA fragmentation (line 3) (adapted from [11])
К основным повреждающим факторам, которые инициируют окислительный стресс в мужских зародышевых клетках, относят инфекции, ожирение, неблагоприятное воздействие окружающей среды, возраст. Окислительный стресс индуцирует перекисное окисление липидов, вследствие чего появляются альдегиды, связывающиеся с белками в митохондриальной цепи переноса электронов и стимулирующие образование АФК. В свою очередь, АФК усиливает окислительный стресс, что может приводить к апоптозу сперматозоидов. Если апоптоз не привел к гибели сперматозоида, то такой сперматозоид с поврежденной ДНК может оплодотворить яйцеклетку в процессе естественной фертилизации или в цикле ВРТ. Яйцеклетка обладает потенциалом репарации и способна восстановить часть поврежденной ДНК сперматозоида. Однако если репарация ДНК не произошла, то могут возникнуть мутации, обусловливающие развитие ряда патологических состояний: выкидыша, доминантных генетических заболеваний, комплексных неврологических состояний, рака, нарушений обмена веществ (рис. 2) и т.д. [17].
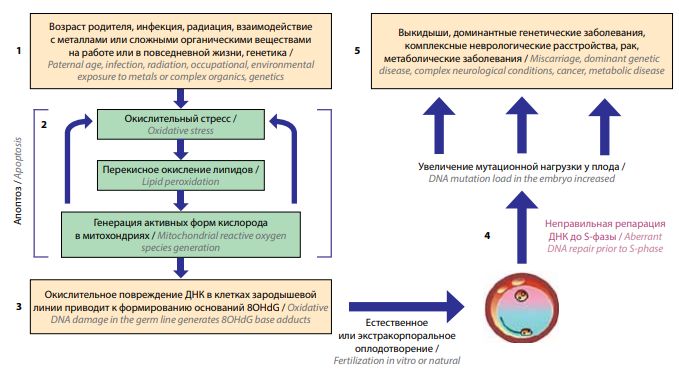
Рис. 2. Механизм влияния фрагментации ДНК сперматозоидов (адаптировано из [17])
Fig. 2. Mechanism of influence of sperm DNA fragmentation (adapted from [17])
Фрагментация ДНК сперматозоидов и потери беременности
В течение последних 10 лет появились публикации о негативном влиянии ФДС на исходы беременности. В 2012 г. опубликовано исследование о взаимосвязи ФДС и идиопатического невынашивания беременности. В анализ было включено 45 пар с 3 и более эпизодами невынашивания беременности на сроке <20 нед, контрольную группу составили 20 пар. Женщины основной группы не имели нарушений по данным общего анализа крови, ультразвукового исследования органов малого таза, гистеросальпингографии или гистероскопии, у них были исключены тромбофилии и гормональные нарушения (уровень Т3, Т4, тиреотропного, фолликулостимулирующего, лютеинизирующего гормонов, пролактина был в норме). У обоих партнеров определен нормальный кариотип, отсутствовали аутоиммунные и эндокринные заболевания. Мужчины из группы контроля имели нормальный кариотип и нормальные параметры спермы. Также в обеих группах были исключены факторы, оказывающие влияние на уровень ФДС (наличие варикоцеле, употребление антиоксидантов и т.д.). Выявлено статистически значимое различие между группами по уровню ФДС: в группе с невынашиванием беременности он составил 28,06 ± 4,99 %, а в группе контроля – 21,75 ± 4,75 % (p = 0,0124) [18].
В другом исследовании проведен сравнительный анализ 3 групп мужчин. В 1-ю группу вошли 112 мужчин из пар с 2–6 выкидышами на сроке до 14 нед, при этом женский фактор невынашивания был исключен; во 2-ю группу – 114 мужчин с 1 или более отклонением в параметрах спермы, с бесплодием в паре на протяжении ≥2 лет, женский фактор бесплодия также был исключен; в 3-ю группу – 114 фертильных мужчин. По результатам исследования продемонстрировано статистически значимое различие (р <0,001) в уровне ФДС между 1-й и 3-й группами (18,8 ± 7,0 и 12,8 ± 5,3 % соответственно), а также 2-й и 3-й группами (20,8 ± 8,9 и 12,8 ± 5,3 % соответственно) [19].
По данным метаанализа 16 исследований, включавших 2969 супружеских пар, у которых суммарно наступило 1252 беременности и произошло 225 случаев прерывания беременности (биохимической и/или клинической), выявлено значительное увеличение частоты выкидышей у женщин в парах, в которых мужчины имели высокий уровень ФДС, по сравнению с парами, в которых мужчины имели низкий уровень ФДС [20]. В руководстве EAU по диагностике и лечению мужского бесплодия сообщается об увеличении уровня ФДС у мужчин с олигозооспермией, что ассоциировано со снижением шансов на зачатие естественным путем и повышением риска раннего прерывания беременности [1]. В руководстве по лечению привычного невынашивания беременности, разработанном Европейским обществом специалистов по репродукции и эмбриологии человека, при 2 и более случаях невынашивания беременности рекомендовано определение уровня ФДС с последующей коррекцией образа жизни мужчины [4].
Методы оценки уровня фрагментации ДНК сперматозоидов
В настоящий момент существует несколько методов оценки уровня ФДС, ниже описаны наиболее широко распространенные из них.
Метод SCSA (sperm chromatin structure assay, исследование дисперсии хроматина сперматозоидов) основан на метахроматических свойствах акридинового оранжевого, который флюоресцирует красным при связывании с одноцепочечной молекулой ДНК и зеленым – при связывании с двухцепочечной. Для проникновения акридинового оранжевого в хроматин сперматозоидов используют высокие температуры и низкий рН, приводящие к деконденсации нуклеопротеидной структуры [21, 22]. Основные преимущества метода – высокая чувствительность и специфичность, возможность подсчета большого количества сперматозоидов методом проточной цитометрии, объективность количественного анализа ДНК; основными недостатками считают необходимость специального оборудования и высокую стоимость [23].
Метод TUNEL (terminal deoxynucleotidyl transferase mediated dUTP nick end labeling) – флуоресцентное мечение одно- и двунитевых разрывов ДНК. Интенсивность люминесценции пропорциональна числу встроенных dUTP и, соответственно, числу разрывов ДНК. В качестве флуорохрома обычно используется флуоресцеин. Рассчитывают процент TUNEL-позитивных клеток.
Известны и модификации метода, например с использованием антифлуоресцеиновых антител. Метод требует малого числа сперматозоидов [21, 22, 24]. Косновным преимуществам метода относят высокую чувствительность и специфичность, возможность подсчета большого количества сперматозоидов методом проточной цитометрии; основные недостатки – необходимость специального оборудования и высокая стоимость [23].
Гель-электрофорез ДНК отдельных клеток (single cell gel electrophoresis), получивший название comet assay, позволяет определить содержание высоко- и низкомолекулярной ДНК по ореолу низкомолекулярной ДНК, напоминающему хвост кометы и получаемому при мини-электрофорезе клеток, иммобилизованных в агарозном геле. Проводят специальную обработку клеток с использованием протеиназы. Подсчитывают число клеток с «хвостом кометы» относительно общего числа клеток; также измеряют длину «хвоста» [21, 25, 26]. Основными преимуществами метода считают невысокую стоимость, высокую чувствительность, возможность количественного анализа повреждений ДНК в отдельных клетках, оценки различных типов повреждений ДНК; основными недостатками – необходимость специального оборудования и проведения анализа опытным лаборантом [23].
В основе метода SCD (sperm chromatin dispersion test, исследование дисперсии хроматина сперматозоидов) лежит следующее различие: сперма с фрагментированной ДНК после проведения кислотной денатурации и удаления ядерных протеинов не образует характерный венчик рассеянных петель ДНК, который наблюдается в сперме с нативной ДНК [27]. Это недорогой и простой в исполнении метод; основным его недостатком считают необходимость специальной подготовки лаборанта [23].
По результатам метаанализа, проведенного в 2018 г., уровень ФДС у бесплодных мужчин был значительно выше (28 исследований, р <0,001) вне зависимости от применяемого метода анализа ФДС. Анализ ROC-кривой, выполненный с учетом всех данных, для четырех методов анализа ФДС выявил пороговое значение уровня ФДС в 20 % с наилучшей парой значений чувствительности (79 %) и специфичности (86 %) [28].
Современные подходы к коррекции повышенного уровня фрагментации ДНК сперматозоидов
Для снижения индекса ФДС необходимо выявить и устранить влияние всех неблагоприятных факторов.
Курение. Известно, что сперматозоиды высокочувствительны к АФК [29], а табак содержит несколько опасных соединений, из-за чего курение увеличивает концентрацию АФК в клетках [30, 31]. Прямая корреляция выраженности окислительного стресса с уровнем ФДС продемонстрирована во многих исследования [32–35]. Другие вещества в составе сигарет, такие как кадмий и свинец, также могут вызвать повреждение ДНК [36]. Никотин вызывает разрывы ДНК спермы [37], а котинин, который является его главным метаболитом, обнаружен в семенной жидкости курильщиков [38]. Известно также, что курение нарушает функцию гипоталамо-гипофизарно-гонадной оси [39].
Алкоголь. Употребление алкоголя ассоциировано с более низкими значениями следующих параметров репродуктивной функции мужчин: объема эякулята, концентрации сперматозоидов, количества подвижных форм и сперматозоидов с нормальной морфологией [40–43], вплоть до развития азооспермии при употреблении больших доз алкоголя [44]. Отрицательное воздействие изменяет метаболизм тестостерона и эстрадиола [45]. Кроме того, прослежена взаимосвязь уровня употребления алкоголя и уровня окислительного стресса [46]. Опубликованы сведения об отрицательном влиянии алкоголя на уровень ФДС как у экспериментальных животных (крыс) [47], так и у человека [48]. Изменения эякулята, вызванные алкоголем, могут быть обратимыми и регрессировать после прекращения его употребления [49].
Срок полового воздержания. Уменьшение длительности полового воздержания с 3–7 дней до 1 дня статистически значимо снижает уровень ФДС у мужчин с бесплодием, что связывают с сокращением срока нахождения сперматозоидов в придатке яичка и ослаблением действия неблагоприятных факторов [50].
Нарушения сна. Нарушения сна, связанные с уменьшением его продолжительности из-за высокой нагрузки на работе и дома, со сменным характером работы, потенцируют снижение уровня тестостерона. Отрицательно влияют на уровень ФДС и гипоксия, развивающаяся при апноэ во сне, и усиление системного воспаления [51]. По некоторым данным, повышение уровня ФДС статистически значимо связано с нерегулярным сном (р <0,01); авторы объясняют этот факт нарушением продукции мелатонина [52].
Условия работы, факторы окружающей среды. Эндокринные дисрапторы, такие как бисфенол А, парабены, синтетические пиретроиды, пестициды и фталаты, попадают в организм человека с загрязненной пищей и водой, при контакте с кожей, дыхании, передаются через плаценту и грудное молоко. Основной механизм действия эндокринных дисрапторов заключается в имитации эндогенных гормонов и конкуренции с ними за связывание с их рецепторами или за воздействие на сигнальные внутриклеточные пути. Выявлены различные эффекты эндогенных дисрапторов, такие как эстрогенный, антиандрогенный и тиреоидоподобный, прямо или косвенно влияющие на продукцию стероидных гормонов, в том числе андрогенов. Опубликованы данные о неблагоприятном воздействии эндокринных дисрапторов на параметры эякулята, в том числе на уровень ФДС [53].
Стресс. Средний и высокий уровень профессионального стресса повышает индекс ФДС, тогда как уровень семейного (жизненного) стресса не оказывает статистически значимого влияния. В качестве возможных механизмов описано усиление апоптоза и некроза сперматозоидов [54]. В экспериментах на животных установлено воздействие психогенного стресса на течение дегенеративных процессов в семенниках, апоптоз клеток семенных канальцев, некроспермию, количество аберрантных делений половых клеток сперматогенного эпителия и количество гамет с фрагментированной ДНК; отмечена тенденция к изменению продукции тестостерона и росту доимплантационных потерь [55].
Ожирение из-за выработки жировой тканью провоспалительных цитокинов усиливает системный окислительный стресс, индуцирует митохондриальную дисфункцию герминогенного эпителия, усугубляя нарушения сперматогенеза. Отрицательное влияние избыточной жировой ткани посредством действия лептина, грелина и резистина проявляется в снижении уровня общего тестостерона и глобулина, связывающего половые гормоны. Возникающий дефицит андрогенов способствует развитию инсулинорезистентности, также усиливающей системный окислительный стресс. Степень выраженности ожирения имеет положительную корреляцию с уровнем ФДС [54, 56, 57].
Хронические заболевания. Гормональные нарушения и соматические заболевания, например сахарный диабет и вирусный гепатит, могут повышать уровень ФДС. В качестве ключевого механизма чаще всего описывают усиление окислительного стресса и нарушение работы гипоталамо-гипофизарно-гонадной оси [56, 58].
Инфекции репродуктивного тракта. Наличие инфекций репродуктивного тракта может усиливать ФДС. Опубликованы данные о неблагоприятном влиянии Chlamydia trachomatis и Mycoplasma genitalium, реализующемся посредством активации окислительного стресса и усиления апоптоза сперматозоидов [59, 60].
Варикоцеле. Точный патофизиологический механизм, посредством которого варикоцеле влияет на сперматогенез и уровень ФДС, неизвестен, но в одном из метаанализов авторы указывают на увеличение скротальной температуры, отток крови от семенной вены и нарушение микроциркуляции. Продемонстрировано также увеличение содержания АФК и маркеров апоптоза в сперме бесплодных мужчин с варикоцеле. Однако следует иметь в виду, что увеличение уровня АФК и маркеров апоптоза часто наблюдается и в сперме бесплодных мужчин без варикоцеле [61].
Антиоксиданты. Поскольку окислительный стресс является одним из важных механизмов формирования ФДС, использование антиоксидантов может снизить уровень ФДС, что демонстрируют результаты как иностранных, так и отечественных исследований. Невысокая стоимость и относительно низкий риск токсичности антиоксидантов делают их привлекательными для пациентов и врачей, поэтому они рекомендованы EAU для лечения мужского бесплодия, однако четкие рекомендации в отношении использования у пациентов с идиопатическим бесплодием пока отсутствуют [2, 62, 63].
Гонадотропины. По данным метаанализа, выполненного D. Santi и соавт., использование гонадотропинов может положительно влиять на индекс ФДС [28]. Однако по данным двойного слепого плацебоконтролируемого исследования, проведенного в 2019 г., снижение уровня ФДС у пациентов с идиопатической олигозооспермией происходит только к концу 3-го месяца терапии менопаузным гонадотропином в сочетании с хорионическим гонадотропином человека у пациентов со средним и высоким уровнем ингибина В [64].
Использование тестикулярных сперматозоидов. По данным недавнего метаанализа, при наличии в анамнезе неудачных попыток ВРТ, использование тестикулярных сперматозоидов может быть эффективным у мужчин без азооспермии с высоким уровнем фрагментации ДНК в эякуляторных сперматозоидах. Более высокий уровень фрагментации ДНК в эякуляторных сперматозоидах обусловлен воздействием АФК во время прохождения придатка яичка [65].
Заключение. В развитии нормальных эмбрионов играет большую роль ДНК сперматозоида, поскольку генетическая информация, передаваемая следующему поколению, зависит от ее целостности. Ввиду неблагоприятного влияния высокого уровня ФДС на вынашивание беременности и частоту выкидышей, необходимо своевременное определение индекса ФДС и его коррекция такими методами, как изменение образа жизни, медикаментозная терапия и, в особых случаях, применение тестикулярных сперматозоидов в лечебных циклах ВРТ (ЭКО + ICSI).
ЛИТЕРАТУРА
- EAU guidelines on male infertility. Ed. by A. Jungwirth. European Association of Urology. 2018. 42 p.
- Greenhall E., Vessey M. The prevalence of subfertility: a review of the current confusion and a report of two new studies. Fertil Steril 1990;54(6):978–83. DOI: 10.1016/s0015-0282(16)53990-9.
- Регистр ВРТ. Отчет за 2016 г. М., 2018. 71 с. Доступно по: http://www.rahr. ru/d_registr_otchet/RegistrART2016.pdf. [ART register. Report 2016. Moscow, 2018. 71 p. (In Russ.) Available at: http:// www.rahr.ru/d_registr_otchet/RegistrART2016.pdf].
- ESHRE guideline: recurrent pregnancy loss. Available at: https://www.eshre.eu/ Guidelines-and-Legal/Guidelines/Recurrent-pregnancy-loss.
- Agarwal А., Said T.М. Role of sperm chromatin abnormalities and DNA damage in male infertility. Hum Reprod Update 2003;9(4):331–45. DOI: 10.1093/humupd/dmg027.
- Seli Е., Sakkas D. Spermatozoal nuclear determinants of reproductive outcome: implications for ART. Hum Reprod Update 2005;11(4):337–49. DOI: 10.1093/humupd/dmi011.
- Simon L., Castillo J., Oliva R., Lewis S.E. Relationships between human sperm protamines, DNA damage and assisted reproduction outcomes. Reprod Biomed Online 2011;23(6):724–34. DOI: 10.1016/j.rbmo.2011.08.010.
- Dada R., Mahfouz R.Z., Kumar R. et al. А comprehensive work up for an asthenozoospermic man with repeated intracytoplasmic sperm injection (ICSI) failure. Andrologia 2011;43(5):368–72. DOI: 10.1111/j.1439-0272.2010.01045.x.
- Santi D., Spaggiari G., Simoni M. Sperm DNA fragmentation index as a promising predictive tool for male infertility diagnosis and treatment management – meta-analyses. Reprod Biomed Online 2018;37(3):315–26. DOI: 10.1016/j.rbmo.2018.06.023.
- Епанчинцева Е.А., Селятицкая В.Г., Митрофанов И.М. и др. Количественные и качественные нарушения в спермограмме и дополнительных анализах эякулята у мужчин из бесплодных пар. Проблемы репродукции 2017;23(6):90–6. [Epanchintseva E.A., Selyatitskaya V.G., Mitrofanov I.M. et al. Quantitative and qualitative abnormalities in spermogram and other semen tests in men from infertile couples. Problemy reproduktsii = Russian Journal of Human Reproduction 2017;23(6):90–6. (In Russ.)]. DOI: 10.17116/repro201723690-96.
- Muratori M., De Geyter C. Chromatin condensation, fragmentation of DNA and differences in the epigenetic signature of infertile men. Best Pract Res Clin Endocrinol Metab 2019;33(1):117–26. DOI: 10.1016/j.beem.2018.10.004.
- Muratori M., Tamburrino L., Marchiani S. et al. Investigation on the origin of sperm DNA fragmentation: role of apoptosis, immaturity and oxidative stress. Mol Med 2015;21:109–22. DOI: 10.2119/molmed.2014.00158.
- Sakkas D., Mariethoz E., St John J.C. Abnormal sperm parameters in humans are indicative of an abortive apoptotic mechanism linked to the Fas-mediated pathway. Exp Cell Res 1999;15;251(2):350–5. DOI: 10.1006/excr.1999.4586.
- Marcon L., Boissonneault G. Transient DNA strand breaks during mouse and human spermiogenesis new insights in stage specificity and link to chromatin remodeling. Biol Reprod 2004;70(4):910–8. DOI: 10.1095/biolreprod.103.022541.
- Aitken R.J., Bronson R., Smith T.B., De Iuliis G.N. The source and significance of DNA damage in human spermatozoa; a commentary on diagnostic strategies and straw man fallacies. Mol Hum Reprod 2013;19(8):475–85. DOI: 10.1093/molehr/gat025.
- Esteves S.C., Roque M., Garrido N. Use of testicular sperm for intracytoplasmic sperm injection in men with high sperm DNA fragmentation: a SWOT analysis. Asian J Androl 2018;20(1):1–8. DOI: 10.4103/aja.aja_7_17.
- Aitken R.J., Smith T.B., Jobling M.S. et al. Oxidative stress and male reproductive health. Asian J Androl 2014;16(1):31–8. DOI: 10.4103/1008-682X.122203.
- Kumar K., Deka D., Singh A. et al. Predictive value of DNA integrity analysis in idiopathic recurrent pregnancy loss following spontaneous conception. J Assist Reprod Genet 2012;29(9):861–7. DOI: 10.1007/s10815-012-9801-3.
- Carlini T., Paoli D., Pelloni M. et al. Sperm DNA fragmentation in Italian couples with recurrent pregnancy loss. Reprod Biomed Online 2017;34(1):58–65. DOI: 10.1016/j.rbmo.2016.09.014.
- Robinson L., Gallos I.D., Conner S.J. et al. The effect of sperm DNA fragmentation on miscarriage rates: a systematic review and meta-analysis. Hum Reprod 2012;27(10):2908–17. DOI: 10.1093/humrep/des261.
- Маркова Е.В., Замай А.С. Фрагментация ДНК в сперматозоидах человека (обзор литературы). Проблемы репродукции 2006;12(4):42–50. [Markova E.V., Zamay A.S. DNA fragmentation in human spermatozoa (literature review). Problemy reproduktsii = Russian Journal of Human Reproduction 2006;12(4): 42–50. (In Russ.)].
- Schlegel P.N., Paduch D.A. Yet another test of sperm chromatin structure. Fertil Steril 2005;84(4):854–9. DOI: 10.1016/j.fertnstert.2005.04.050.
- Божедомов В.А., Виноградов И.В., Липатова Н.А. и др. Нарушения структуры хроматина сперматозоидов: клиническое значение, причины, диагностика, лечение (обзор литературы). Проблемы репродукции 2012;(5):80–8. [Bozhedomov V.A., Vinogradov I.V., Lipatova N.A. et al. Abnormality of the sperm chromatin structure: clinical value, causes, diagnosis and treatment (a review). Problemy reproduktsii = Russian Journal of Human Reproduction 2012;(5):80–8. (In Russ.)].
- Benchaib M., Braun V., Lornage J. et al. Sperm DNA fragmentation decreases the pregnancy rate in an assisted reproductive technique. Hum Reprod 2003;18(5):1023–8. DOI: 10.1093/humrep/deg228.
- Morris I.D., Ilott S., Dixon L., Brison D.R. The spectrum of DNA damage in human sperm assessed by single cell gel electrophoresis (Comet assay) and its relationship to fertilization and embryo development. Hum Reprod 2002;17(4):990–8. DOI: 10.1093/humrep/17.4.990.
- Tomsu M., Sharma V., Miller D. Embryo quality and IVF treatment outcomes may correlate with different sperm comet assay parameters. Hum Reprod 2002;17(7):1856–62. DOI: 10.1093/humrep/17.7.1856.
- Fernandez J.L., Muriel L., Rivero M.T. et al. The sperm chromatin dispersion test: A simple method for the determination of sperm DNA fragmentation. J Androl 2003;24(1):59–66.
- Santi D., Spaggiari G., Simoni M. Sperm DNA fragmentation index as a promising predictive tool for male infertility diagnosis and treatment management – metaanalyses. Reprod Biomed Online 2018;37(3):315–26. DOI: 10.1016/j.rbmo.2018.06.023.
- Maneesh M., Jayalekshmi H. Role of reactive oxygen species and antioxidants on pathophysiology of male reproduction. Indian J Clin Biochem 2006;21(2):80–9. DOI: 10.1007/BF02912918.
- Traber M.G., van der Vliet A., Reznick A.Z., Cross C.E. Tobacco-related diseases. Is there a role for antioxidant micronutrient supplementation? Clin Chest Med 2000;21(1):173–87. DOI: 10.1016/S0272-5231(05)70016-2.
- Saleh R.A., Agarwal A., Sharma R.K. et al. Effect of cigarette smoking on levels of seminal oxidative stress in infertile men: a prospective study. Fertil Steril 2002;78(3):491–9. DOI: 10.1016/s0015-0282(02)03294-6.
- Anifandis G., Bounartzi T., Messini C.I. et al. The impact of cigarette smoking and alcohol consumption on sperm parameters and sperm DNA fragmentation (SDF) measured by Halosperm(®). Arch Gynecol Obstet 2014;290(4):777–82. DOI: 10.1007/s00404-014-3281-x.
- Fariello R.M., Pariz J.R., Spaine D.M. et al. Effect of smoking on the functional aspects of sperm and seminal plasma protein profiles in patients with varicocele. Hum Reprod 2012;27(11):3140–9. DOI: 10.1093/humrep/des287.
- Linschooten J.O., Laubenthal J., Cemeli E. et al. Incomplete protection of genetic integrity of mature spermatozoa against oxidative stress. Reprod Toxicol 2011;32(1):106–11. DOI: 10.1016/j.reprotox.2011.05.004.
- Taha E.A., Ez-Aldin A.M., Sayed S.K. et al. Effect of smoking on sperm vitality, DNA integrity, seminal oxidative stress, zinc in fertile men. Urology 2012;80(4): 822–5. DOI: 10.1016/j.urology.2012.07.002.
- Hengstler J.G., Bolm-Audorff U., Faldum A. et al. Occupational exposure to heavy metals: DNA damage induction and DNA repair inhibition prove coexposures to cadmium, cobalt and lead as more dangerous than hitherto expected. Carcinogenesis 2003;24(1):63–73. DOI: 10.1093/carcin/24.1.63.
- Arabi M. Nicotinic infertility: assessing DNA and plasma membrane integrity of human spermatozoa. Andrologia 2004;36(5):305–10. DOI: 10.1111/j.1439-0272.2004.00623.x.
- Wong W.Y., Thomas C.M., Merkus H.M. et al. Cigarette smoking and the risk of male factor subfertility: Minor association between cotinine in seminal plasma and semen morphology. Fertil Steril 2000;74(5):930–5. DOI: 10.1016/s0015-0282(00)01567-3.
- Ramlau-Hansen C.H., Thulstrup A.M., Aggerholm A.S. et al. Is smoking a risk factor for decreased semen quality? A cross-sectional analysis. Hum Reprod 2007;22(1):188–96. DOI: 10.1093/humrep/del364.
- Gaur D.S., Talekar M.S., Pathak V.P. Alcohol intake and cigarette smoking: Impact of two major lifestyle factors on male fertility. Indian J Pathol Microbiol 2010;53(1):35–40. DOI: 10.4103/0377-4929.59180.
- Martini A.C., Molina R.I., Estofán D. et al. Effects of alcohol and cigarette consumption on human seminal quality. Fertil Steril 2004;82(2):374–7. DOI: 10.1016/j.fertnstert.2004.03.022.
- Muthusami K.R., Chinnaswamy P. Effect of chronic alcoholism on male fertility hormones and semen quality. Fertil Steril 2005;84(4):919–24. DOI: 10.1016/j.fertnstert.2005.04.025.
- Stutz G., Zamudio J., Santillán M.E. et al. The effect of alcohol, tobacco, and aspirin consumption on seminal quality among healthy young men. Arch Environ Health 2004;59(11):548–52. DOI: 10.1080/00039890409603432.
- Guthauser B., Boitrelle F., Plat A. et al. Chronic excessive alcohol consumption and male fertility: a case report on reversible azoospermia and a literature review. Alcohol Alcohol 2014;49(1):42–4. DOI: 10.1093/alcalc/agt133.
- Hansen M.L., Thulstrup A.M., Bonde J.P. et al. Does last week’s alcohol intake affect semen quality or reproductive hormones? A cross-sectional study among healthy young Danish men. Reprod Toxicol 2012;34(3):457–62. DOI: 10.1016/j.reprotox.2012.06.004.
- Silva J.V., Cruz D., Gomes M. et al. Study on the short-term effects of increased alcohol and cigarette consumption in healthy young men’s seminal quality. Sci Rep 2017;7:45457. DOI: 10.1038/srep45457.
- Talebi A.R., Sarcheshmeh A.A., Khalili M.A., Tabibnejad N. Effects of ethanol consumption on chromatin condensation and DNA integrity of epididymal spermatozoa in rat. Alcohol 2011;45(4):403–9. DOI: 10.1016/j.alcohol.2010.10.005.
- Borges E. Jr, Braga D.P.A.F., Provenza R.R. et al. Paternal lifestyle factors in relation to semen quality and in vitro reproductive outcomes. Andrologia 2018;50(9):e13090. DOI: 10.1111/and.13090.
- La Vignera S., Condorelli R.A., Balercia G. et al. Does alcohol have any effect on male reproductive function? A review of literature. Asian J Androl 2013;15(2):221–5. DOI: 10.1038/aja.2012.118.
- Pons I., Cercas R., Villas C. et al. One abstinence day decreases sperm DNA fragmentation in 90 % of selected patients. J Assist Reprod Genet 2013;30(9):1211–8. DOI: 10.1007/s10815-013-0089-8.
- Palnitkar G., Phillips C.L., Hoyos C.M. et al. Linking sleep disturbance to idiopathic male infertility. Sleep Med Rev 2018;42:149–59. DOI: 10.1016/j.smrv.2018.07.006.
- Shi X., Chan C.P.S., Waters T. et al. Lifestyle and demographic factors associated with human semen quality and sperm function. Syst Biol Reprod Med 2018;64(5):358–67. DOI: 10.1080/19396368.2018.1491074.
- Zamkowska D., Karwacka A., Jurewicz J., Radwan M. Environmental exposure to non-persistent endocrine disrupting chemicals and semen quality: an overview of the current epidemiological evidence. Int J Occup Med Environ Health 2018;31(4):377–414. DOI: 10.13075/ijomeh.1896.01195.
- Radwan M., Jurewicz J., Merecz-Kot D. et al. Sperm DNA damage – the effect of stress and everyday life factors. Int J Impot Res 2016;28(4):148–54. DOI: 10.1038/ijir.2016.15.
- Макутина В.А., Балезин С.Л., Рослый О.Ф. и др. Экспериментальная оценка репродуктивной функции самцов крыс при воздействии психогенного стресса. Вестник уральской медицинской академической науки 2013;(3):69–72. [Makutina V.A., Balezin S.L., Rosliy O.F. et al. Effects of psychogenic stress on the reproductive function in male rats. Vestnik uralskoy meditsinskoy akademicheskoy nauki = Journal of Ural Medical Academic Science 2013;(3):69–72. (In Russ.)].
- Епанчинцева Е.А. Абдоминальное ожирение как фактор риска нарушений сперматогенеза и бесплодия у мужчин. Автореф. дис. … канд. мед. наук. Новосибирск, 2015. 27 с. [Epanchintseva E.A. Abdominal obesity as a risk factor for disorders of spermatogenesis and infertility in men. Abstract of dis. … сand. med. sciences. Novosibirsk, 2015. 27 p. (In Russ.)].
- Al Omrani B., Al Eisa N., Javed M. et al. Associations of sperm DNA fragmentation with lifestyle factors and semen parameters of Saudi men and its impact on ICSI outcome. Reprod Biol Endocrinol 2018;16(1):49. DOI: 10.1186/s12958-018-0369-3.
- Gong D.Y., Li Z.P., Yao H.Y. [Oxidative stress and semen parameters in the serum and seminal plasma of infertile men with chronic viral hepatitis (In Chinese)]. Zhonghua Nan Ke Xue 2015;21(1):48–52.
- Gallegos G., Ramos B., Santiso R. et al. Sperm DNA fragmentation in infertile men with genitourinary infection by Chlamydia trachomatis and Mycoplasma. Fertil Steril 2008;90(2):328–34. DOI: 10.1016/j.fertnstert.2007.06.035.
- Андрология. Фармакотерапия без ошибок. Руководство для врачей. Под ред. А.А. Камалова. М.: Е-ното, 2017. 384 с. [Andrology. Pharmacotherapy without errors. A guide for physicians. Ed. by A.A. Kamalov. Moscow: E-Noto, 2017. 384 p. (In Russ.)].
- Zini A., Dohle G. Are varicoceles associated with increased deoxyribonucleic acid fragmentation? Fertil Steril 2011;96(6):1283–7. DOI: 10.1016/j.fertnstert.2011.10.016.
- Greco E., Iacobelli M., Rienzi L. et al. Reduction of the incidence of sperm DNA fragmentation by oral antioxidant treatment. J Androl 2005;26(3):349–53. DOI: 10.2164/jandrol.04146.
- Божедомов В.А., Липатова Н.А., Божедомова Г.Е. и др. Применение комплекса нутриентов для лечения мужского бесплодия. Русский медицинский журнал 2016;23:1546–52. [Bozhedomov V.A., Lipatova N.A., Bozhedomova G.E. et al. Food additive for male infertility. Russky meditsinsky zhurnal = Russian Medical Journal 2016;23:1546–52. (In Russ.)].
- Zhao N., Lu X., Li J., Zhang J.M. Treatment of idiopathic oligozoospermia with combined human chorionic gonadotropin/human menopausal gonadotrophin: a randomised, doubleblinded, placebo-controlled clinical study. Andrologia 2019;51(6):e13271. DOI: 10.1111/and.13271.
- Esteves S.C., Roque M., Bradley C.K. et al. Reproductive outcomes of testicular versus ejaculated sperm for intracytoplasmic sperm injection among men with high levels of DNA fragmentation in semen: systematic review and meta-analysis. Fertil Steril 2017;108(3):456–67. DOI: 10.1016/j.fertnstert.2017.06.018.