Внеклеточная ДНК при доброкачественной гиперплазии предстательной железы у старых и молодых крыс
Васильева И.Н., Беспалов В.Г., Семенов А.Л., Точильников Г.В., Романов В.А., Александров В.А.
Сведения об авторах:
- Васильева И.Н. – к.б.н., старший научный сотрудник научной лаборатории химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, iravasilyeva@hotmail.com, AuthorID 197193
- Беспалов В.Г. – д.м.н., заведующий научной лабораторией химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, профессор международного научного центра “Биотехнологии третьего тысячелетия” университета
- ИТМО, bespalov_niio@mail.ru, AuthorID 80752
- Семенов А.Л. – научный сотрудник научной лаборатории химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, genesem7@gmail.com, AuthorID 900704
- Точильников Г.В. – к.м.н., научный сотрудник научной лаборатории химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, gr75@mail.ru, AuthorID 879476
- Романов В.А. – лаборант научной лаборатории химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, vova-varxan@yandex.ru
- Александров В.А. – д.м.н., профессор научной лаборатории химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, alexandrov.valeri@yandex.ru, AuthorID 80753
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является заболеванием с высокой встречаемостью и непрерывным приростом более половины мужчин старше 50 испытывают симптомы ДГПЖ, и уже к 80 годам эта цифра достигает 80% [1]. Существующая ранняя диагностика неспецифична и, зачастую, субъективна, что создает потребность в дополнительных инструментальных обследованиях, накладывая существенное бремя как на самого пациента, так и на систему здравоохранения [2]. В качестве неинвазивного биомаркера ДГПЖ и рака предстательной железы (ПЖ) сегодня предлагается определять уровень внеклеточной ДНК (внДНК) в периферической крови [3,4]. При этом известно, что внДНК успешно обнаруживается в 50% образцов плазмы и более чем в 70% образцов мочи, а специфичность и чувствительность таких тестов колеблется в пределах от 80% до 99,9% [3]. В сравнении, специфичность тестов на определение простатспецифического антигена (ПСА) не превышает 70% [4].
ВнДНК представляет собой продукт гибели клеток, связанный с апоптозом, некрозом и фагоцитозом. Продолжительная циркуляция внДНК в крови может свидетельствовать о наличии в организме доброкачественных или злокачественных очагов патологий, дифференцирование которых связано с определением общего уровня и целостности внклДНК [4-6]. При раке ПЖ в частности, и злокачественных новообразованиях в целом, наблюдается преобладание некроза, что связывают с выделением в кровоток большого количества неупорядоченных фрагментов внДНК различной длины. В то же время, ДГПЖ связывают с процессами апоптоза, в которых происходит преобладание фрагментов внДНК в пределах от 180 до 210 пн. Известно, что уровень внДНК при ДГПЖ выше, чем в популяции здоровых мужчин, однако значимо ниже, чем среди мужчин с раком ПЖ [4].
Цель настоящего исследования – изучение содержания внДНК в крови у молодых и старых крыс в норме и при индукции доброкачественной гиперплазии предстательной железы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено на 45 самцах крыс линии Вистар двух возрастных групп: в возрасте 3 и 24 месяца, весом 140-160 и 300-350 г, соответственно, полученных из питомника лабораторных животных «Рапполово» (Ленинградская область). Содержание животных соответствовало стандартным условиям вивария барьерного типа, с температурой воздуха 22±3°С и относительной влажностью 50±10%, при контролируемом 12/12 световом режиме. Животные были размещены в полипропиленовых клетках, до пяти самцов в каждой, получая стандартный комбикорм для содержания лабораторных грызунов (ООО Лабораторкорм, Москва) и питьевую водопроводную воду ad libitum. Все манипуляции осуществлялись по разрешению этического комитета ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России и в соответствии с требованиями директивы 2010/63/EU Европейского Союза.
Индукция доброкачественной гиперплазии предстательной железы
Через 7 дней после размещения животные в обеих возрастных выборках были рандомизированы на группу интактного контроля и группу индукции ДГПЖ (всего 4 группы). На 1-ый день эксперимента осуществлялась хирургическая кастрация: орхидэктомия производилась в стерильных условиях под эфирным наркозом путем разреза по средней линии мошонки. После перевязывания семенного канатика и сосудов производилось удаление яичек с придатками. Культя семенного канатика заправлялась через ингвинальный канал в брюшную полость, после чего мошонку зашивали. Начиная с 7-х суток после орхидэктомии и далее через день животные подкожно получали тестостерон (Omnadren 250, Jelfa, Poland) в дозе 25 мг/кг массы тела, суммарно 7 инъекций, в течение 20 дней. Через 7 дней после последней инъекции (36-й день после кастрации) производился забой животных парами эфира, осуществлялись забор крови и выделение ПЖ.
Анализ предстательной железы
Всем животным произведена полная аутопсия. ПЖ изолировалась в виде комплекса дорсолатерального отдела, вентральных долей ПЖ и семенных пузырьков с передними долями ПЖ (коагуляционными железами). ПЖ очищали от других тканей, доли разделялись и взвешивались – отдельно дорсолатеральный отдел, попарно – вентральные и передние доли. Для оценки увеличения ПЖ рассчитывали простатический индекс (ПИ) как отношение веса дорсолатеральной и вентральных долей ПЖ в мг/100 г веса тела.
Гистологический и морфологический анализ тканей предстательной железы
ПЖ крыс фиксировали в 10% забуференном нейтральном формалине и далее производилась стандартная гистологическая обработка. С заключенных в парафине блоков тканей ПЖ производились срезы толщиной 5 мкм и окрашивались гематоксилин-эозином. Морфологический анализ проводили при световой микроскопии.
Уровень внеклеточной ДНК в периферической крови
Содержание внДНК в плазме крови определяли с использованием набора Cell Death Detection Elisa (Roche, Sigma-Aldrich). Определение основано на количественном сэндвич-иммуноферментном анализе. Два мышиных антитела против ДНК (однои двухнитевой) и гистонов (Н1, Н2А, Н2В, Н3 и Н4) специфично связывают монои олигонуклеосомы, происходящие из ядер эукариотических клеток (Cat. No.11 774 425 001, sigma-aldrich.com). Измерение абсорбции с длиной волны 450±10 нм проводили на планшете Microplane reader ChroMate (Awareness Thechnology Inc, США). Измеряли концентрацию ДНК положительного контроля набора Elisa спектрофотометрически (NanoPhotometer N-50, Implen, Германия). При разведении положительного контроля строили калибровочную кривую для определения количества внДНК в пробах.
Уровень тестостерона в периферической крови Уровень тестостерона в сыворотке крови определялся иммуноферментно с использованием набора «DRG Testosteron ELISA» (DRG Instruments GmbH, Германия). Измерение абсорбции с длиной волны 450±10 нм проводили на планшете Microplane reader ChroMate (Awareness Thechnology Inc, США).
Статистический анализ Данные представлены как среднее ± SEM (стандартная ошибка среднего). Анализ проводился при помощи программного обеспечения GraphPad Prism 7, значимость различий оценивалась по t-критерию Стьюдента. Значения p<0,05 считали статистически значимыми.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты исследования представлены в таблице 1. В группе интактных животных уровень внДНК у старых крыс был достоверно выше, чем у молодых (p<0,05). Масса тела старых крыс была в 1,6 раз больше, чем у молодых (p<0,001), в то время как масса ПЖ в 1,4 раза. Различия в величине ПИ у молодых и старых крыс не были статистически значимы. Уровень тестостерона в крови молодых крыс был в 1,6 раз выше, чем у старых (p<0,05). Морфологическое исследование тканей ПЖ молодых крыс не выявило наличия ДГПЖ, в то время как у старых животных наблюдалась очаговая гиперплазия (рис.1).
Таблица 1. Сводный анализ показателей в группе крыс с ДГПЖ и в группе контроля
Table 1. Summary analysis of indicators in the group of rats with BPH and in the control group
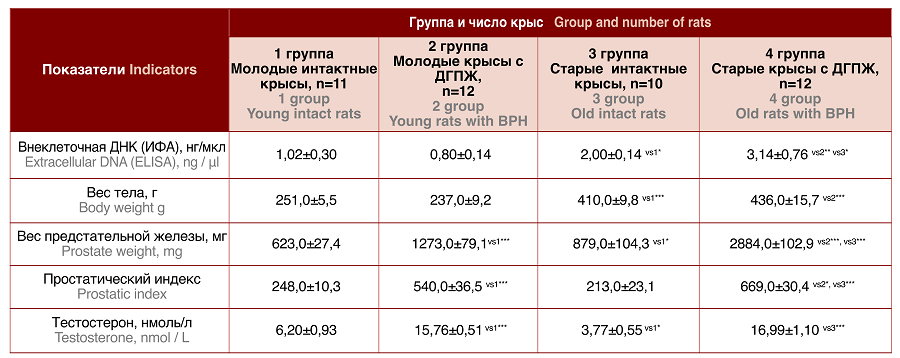
Достоверность отличий отмечена: vs1 – с группой 1; vs2 – с группой 1; vs3 – с группой 3; * p<0,05, ** p<0,01, *** p<0,001
Significance of differences is noted: vs1 – with group 1; vs2 – with group 1; vs3 – with group 3; * p<0.05, **p<0.01, ***p<0.001
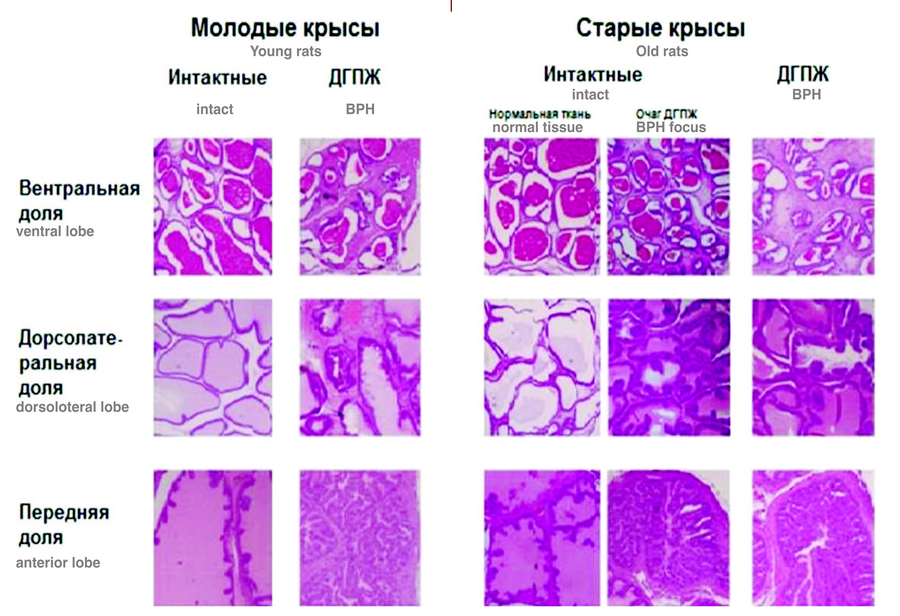
Рис. 1. Гистологические особенности ДГПЖ у старых и молодых крыс. Молодые интактные крысы: вентральная доля предстательной железы (ПЖ) – ацинусы ровные, овальной формы с тонкими стенками без складок, равномерно заполненные секретом; дорсолотеральная доля ПЖ – ацинусы ровные, произвольной формы с тонкими стенками допускается складчатость, равномерно заполненные секретом; передняя доля ПЖ – крупные ацинусы, стенки складчатые двуслойные. Молодые крысы, ДГПЖ: вентральная доля ПЖ – изменение клеточных стенок ацинусов, появляется складчатость, выраженная гиперплазия мышечной ткани; дорсолотеральная доля ПЖ – выраженная гиперплазия стенок ацинусов и мышечной ткани; передняя доля ПЖ – стенки ацинусов с выраженной гиперплазией. Старые интактные крысы: вентральная доля ПЖ – появляются признаки ДГПЖ в скоплении и умельчении ацинусов, обнаруживается складчатость; дорсолотеральная доля ПЖ – наблюдается низкое содержание секрета, складчатость стенок; передняя доля ПЖ – признаки ДГПЖ: очаговая высокая складчатость. Старые крысы, ДГПЖ: вентральная доля ПЖ – очаговая складчатость ацинусов и гиперплазия мышечной ткани; дорсолотеральная доля ПЖ – выраженная гиперплазия мышечной ткани, утолщение стенок; передняя доля ПЖ – стенки ацинусов и мышечная ткань с выраженной гиперплазией.
Fig. 1. Histological features of BPH in old and young rats Young intact rats: ventral prostate lobe – acini smooth, oval in shape with thin walls without folds, uniformly filled with secretion; dorsoloteral prostate lobe – acini smooth, of arbitrary shape with thin walls, folding is allowed, evenly filled with secretion; anterior prostate lobe – large acini, folded bilayer walls. Young rats, BPH: ventral prostate lobe – a change in the cell walls of the acini, there is folding, severe hyperplasia of muscle tissue; dorsoloteral prostate lobe – severe hyperplasia of the walls of the acini and muscle tissue; the anterior prostate lobe is the wall of the acini with severe hyperplasia. Old intact rats: ventral prostate lobe – there are signs of BPH in the accumulation and reduction of acini, folding is detected; dorsoloteral prostate lobe – there is a low content of secretion, folding of the walls; anterior prostate lobe – signs of BPH: focal high folding. Old rats, BPH: ventral prostate lobe – focal folding of the acini and hyperplasia of muscle tissue; dorsoloteral prostate lobe – severe hyperplasia of muscle tissue, thickening of the walls; anterior prostate lobe – the walls of the acini and muscle tissue with severe hyperplasia.
В группе животных с ДГПЖ уровень внДНК у старых крыс аналогично был достоверно выше, чем у молодых (p<0,001). Масса тела старых крыс оказалась в 1,8 раз больше, чем у молодых (p<0,001), в то время как масса ПЖ в 2,3 раза (p<0,001). Величина ПИ у старых крыс была статистически значимо выше, чем у молодых (p<0,05). Уровень тестостерона в крови молодых и старых крыс значимо не отличался (табл. 1). Морфологический анализ молодых и старых животных подтвердил наличие ДГПЖ.
ОБСУЖДЕНИЕ
Нами обнаружено значимое увеличение уровня внДНК у старых крыс по сравнению с молодыми, что коррелирует с данными литературы о возрастных увеличениях уровня внДНК у человека [7]. Следует отметить, что возрастные изменения у крыс сопровождаются значимым увеличением массы тела животного. Установлено, что скорость апоптоза c возрастом повышается во многих клеточных популяциях и органах, включая центральную нервную, сердечно-сосудистую, иммунную, эндокринную и репродуктивную системы [8]. Полагают, что у пожилых людей внДНК выделяется не только в связи системной потерей клеток, но и в результате хронических воспалительных процессов [7].
Сегодня известно, что присутствие хронического воспаления, как у человека, так и у животных, представляет собой фактор риска предраковых и раковых состояний в разных органах, в том числе в ПЖ. При этом, развитие ДГПЖ связывают с нарушением баланса клеточной пролиферации и апоптоза [4]. Полагают, что в основе развития ДГПЖ лежит снижение апоптоза в тканях ПЖ [9]. В частности, показано, что с возрастом атрофические ацинусы в ограниченных участках эпителия ПЖ сохраняются, не подвергаясь апоптозу [9]. Однако, присутствие в тканях большого количества дефектных клеток способствует формированию провоспалительного фенотипа, вызывая аккумуляцию иммунокомпетентных клеток в тканях ПЖ, а именно Т-лимфоцитов и макрофагов [10]. Эпителиальные и стромальные клетки ПЖ, а также воспалительные клетки индуцируют локальный иммунный ответ. При достижении критического уровня Т-лимфоцитов происходит разрушение клеток ПЖ CD8+цитотоксичными Т-клетками. Это приводит к замещению тканей ПЖ фиброзномышечными узлами и увеличению объема ПЖ. Вероятно, при этом в крови продолжительно присутствуют фрагменты внДНК замещенных железистых клеток.
Другим объяснением увеличения гибели клеток и повышения общего уровня внДНК могут являться возрастные нарушения кровообращения и локальная гипоксия, которые приводят к образованию очагов ишемии в органах малого таза [11]. В результате, ишемический некроз и сопутствующие процессы апоптоза приводят к появлению в кровотоке внДНК [12].
В нашем эксперименте среди старых особей при развитии ДГПЖ увеличение уровня внДНК коррелировало с наибольшим увеличением веса ПЖ и ПИ, а также сопровождалось гистологическими изменениями ткани ПЖ (рис. 1). Стоит отметить, что уже у интактных старых особей наблюдались признаки очаговой гиперплазии, а у старых крыс с ДГПЖ гиперплазия значительно прогрессировала. Таким образом, накопление очагов воспаления и ремоделирование тканей ПЖ в когорте старых особей приводило к высвобождению внДНК в системный кровоток, повышение уровня которой можно наблюдать в нашем эксперименте.
С другой стороны, можно говорить и о гормональной природе развития ДГПЖ и ее связи с естественными процессами старения. В нашем исследовании, уровень тестостерона у старых интактных крыс был статистически значимо ниже такового у молодых интактных животных, однако, уровень внДНК у молодых интактных крыс был достоверно ниже. Показано, что тестостерон защищает клетки от повреждений, вызванных окислительным стрессом [13]. В то же время окислительный стресс влияет на накопление гранул липофусцина и может индуцировать апоптоз в различных типах клеток [13]. Так, естественное падение уровня тестостерона с возрастом может вызвать увеличение апоптоза, что коррелирует с высоким содержанием внДНК в крови.
Не стоит оставлять без внимания, что у молодых крыс с ДГПЖ уровень внДНК был значительно ниже, чем у старых, при относительно равном уровне тестостерона. При этом вес тела и вес ПЖ у молодых крыс был практически в два раза меньше, чем у старых крыс. Таким образом, воздействие тестостерона на старых и молодых крыс при развитии ДГПЖ существенно различалось. Судя по уровню внДНК процессы клеточной гибели не изменялись значимо после действия тестостерона у молодых животных и увеличивались у старых. Вероятно, у молодых крыс тестостерон стимулирует пролиферативные процессы [14], тем самым частично компенсируя сопутствующие ДГПЖ нарушения [15].
Мы предполагаем, что повышение уровня внДНК у старых крыс связано с активацией апоптоза, сопровождающего рост ткани ПЖ, по сравнению с молодыми животными. С одной стороны, рост ткани ПЖ во время развития ДГПЖ у старых крыс, возможно, сопровождается активной секрецией небольших количеств ДНК [16], что затем приводит к значительному увеличению содержания внДНК путем индукции апоптоза, как показано in vitro и in vivo [17]. С другой стороны, повышенный уровень внДНК у старых крыс, связанный с повышенным апоптозом, в результате межклеточной передачи сигналов растворимыми факторами секреции, внеклеточными везикулами и макрофагами, вовлеченными в апоптоз, приводит к образованию ниши для пролиферации клеток, вызывая усиление роста ПЖ [18]. Возможно, что у старых крыс могут быть активированы другие процессы гибели клеток, например, пироптоз, который отличается от апоптоза, некроза или онкоза, фагоцитоза клеток и их остатков, а также NETosis, который может не сопровождаться гибелью нейтрофилов [16].
ДГПЖ и рак ПЖ [19] представляют собой значительную проблему для стареющего мужского населения во всем мире, и, как ожидается, актуальность этой проблемы будет только расти ввиду увеличения средней продолжительности жизни. Тем не менее, диагностика как доброкачественных, так и злокачественных заболеваний ПЖ остается неспецифичной и субъективной, что требует дополнительных инструментальных исследований для подтверждения диагноза. Это не только накладывает свой отпечаток на качество жизни пациента и смертность, но и несет экономическое бремя для системы здравоохранения в целом. В частности, специфичность традиционного ПСА теста может варьировать от 30% до 70%, в большинстве случаев требует проведении биопсии и не способна дифференцировать ДГПЖ и рак ПЖ. Кроме того существуют сведения об увеличении хронического воспаления, эректильной дисфункции, развития синдрома нижних мочевых путей в результате повторных биопсий [20]. В сравнениис этим, по данным ряда исследователей, самая простая ПЦР диагностика внДНК, являясь неинвазивной техникой, позволяет добиться специфичности и чувствительности на уровне не менее 70% и способна взаимоисключать доброкачественные и злокачественные заболевания ПЖ [3,4].
ЗАКЛЮЧЕНИЕ
Уровень внДНК у старых и молодых крыс существенно различался. При индукции ДГПЖ в эксперименте, судя по уровню внДНК, процессы клеточной гибели не изменялись значимо у молодых крыс, однако значительно увеличивались у старых животных. Аналогичная тенденция наблюдалась и в группе интактных животных, однако была достоверно ниже, чем при ДГПЖ. Таким образом, у стареющих животных внДНК отражала прогрессирование ДГПЖ от частичной атрофии тканей ПЖ к прогрессирующей гиперплазии, чему сопутствовали процессы апоптоза и повышение уровня внДНК в крови. Полученные данные свидетельствуют об усилении процессов апоптоза при развитии ДГПЖ вопреки росту тканей в самой ПЖ. Учитывая, что ДГПЖ относят к заболеваниям стареющих мужчин, полученные результаты подтверждают необходимость дальнейших исследований диагностической значимости внДНК как неинвазивного биомаркера, что позволит обеспечить пациентов персонализированной диагностикой и более точным лечением.
ЛИТЕРАТУРА
- Chughtai B, Forde JC, Thomas DDM, Laor L, Hossack T, Woo HH. et al. Benign prostatic hyperplasia. Nat Rev Dis Prim 2016;2:16031. doi: 10.1038/nrdp.2016.31.
- Ahn J-M, Sung H-J, Yoon Y-H, Kim B-G, Yang WS, Lee C et al. Integrated Glycoproteomics Demonstrates Fucosylated Serum Paraoxonase 1 Alterations in Small Cell Lung Cancer. Mol Cell Proteomics 2014;13(1):30-48. doi.org/10.1074/mcp. M113.028621.
- Di Meo A, Bartlett J, Cheng Y, Pasic MD, Yousef GM. Liquid biopsy: a step forward towards precision medicine in urologic malignancies. Mol Cancer 2017; 16(1):80. doi: 10.1186/s12943-017-0644-5.
- Feng J, Gang F, Li X, Jin T, Houbao H, Yu C. Guorong L. Plasma cell-free DNA and its DNA integrity as biomarker to distinguish prostate cancer from benign prostatic hyperplasia in patients with increased serum prostate-specific antigen. Int Urol Nephrol 2013;45(4):1023–1028. doi: 10.1007/s11255-013-0491-2.
- Васильева И.Н., Беспалов В.Г., Зинкин В.Н. Низкочастотный шум как вредный фактор, повышающий частоту хромосомных аберраций и усиливающий клеточную гибель. Медицина труда и промышленная экология. 2017;3:22-26. [Vasilyeva I.N., Bespalov V.G., Zinkin V.N. Low-Frequency Noise as a hazard increasing occurrence of chromosomal aberrations and promoting cell death. Meditsina truda i promyshlennaya ekologiya = Russian journal of occupational health and industrial ecology. 2017;3:22-26. (In Russian)].
- Васильева И.Н., Беспалов В.Г. Выделение внеклеточной ДНК после введения радиозащитной комбинации α-токоферола и аскорбиновой кислоты. Радиационная биология. Радиоэкология. 2017;55(5):495-500. [Vasilyeva I.N., Bespalov V.G. Release of extracellular DNA after administration of radioprotective combination of α-tocopherol and ascorbic acid. Radiation biology. Radioecology=Radioecologiya 2015;55(5):495–500. (In Russian)].
- Jylhävä J, Nevalainen T, Marttila S, Jylhä M. Hervonen A, Hurme M. Characterization of the role of distinct plasma cell-free DNA species in age-associated inflammation and frailty. Aging Cell. 2013;12(3):388–397. doi: 10.1111/acel.12058.
- Lu B, Chen H-D, Hong-Guang H-G. The relationship between apoptosis and aging. Adv Biosci Biotechnol 2012;3(6A):705–711. doi: 10.4236/abb.2012.326091.
- Gonzaga ACR, Campolina-Silva GH, Werneck-Gomes H, Moura-Cordeiro JD, Santos LC, Mahecha GAB. et al. Profile of cell proliferation and apoptosis activated by the intrinsic and extrinsic pathways in the prostate of aging rats. Prostate. 2017;77(9):937–948. doi: 10.1002/pros.23349.
- Krušlin B, Tomas D, Džombeta T, Milković-Periša M, Ulamec M. Inflammation in Prostatic Hyperplasia and Carcinoma—Basic Scientific Approach. Frontiers in Oncology 2017;7:77. doi: 10.3389/fonc.2017.00077.
- Кирпатовский В.И., Мудрая И.С., Мкртчян К.Г., Ревенко С.В., Ефремов Г.Д., Надточий О.Н., Кабанова И.В. Ишемия тазовых органов как самостоятельный патогенетический фактор развития доброкачественной гиперплазии предстательной железы и дисфункции мочевого пузыря. Бюллетень экспериментальной биологии и медицины. 2014;158(12):676-680. doi: 10.1007/s10517-015-2845-5. [Kirpatovskii V.I., Mudraya I.S., Mkrtchyan K.G., Revenko S.V., Efremov G.D., Nadtochii O.N., Kabanova I.V. Ischemia in pelvic organs as an independent pathogenic factor in the development of benign prostatic hyperplasia and urinary bladder dysfunction. Byulleten eksperimentalnoy biologii i meditsiny = Bullttin of Experimental Biology and Medicine 2014; 158(6):718–722.(In Russian)].
- Васильева И.Н., Ивчик Т.В., Вознюк И.А. Роль низкомолекулярной фракции ДНК плазмы крови в диагностике патологического процесса при радиационном поражении и некоторых заболеваниях. Молекулярная медицина. 2011; 5: 35-38. [Vasilyeva I.N., Ivtchik T.V., Voznyuk I.A. The role of low-molecular-wight DNA in blood plasma in the diagnosis of pathological process in radiation injury and some disease. Molekulyarnaya meditsina = Molecular medicine 2011; 5: 35-38. (In Russian)].
- Jara M, Carballada R, Esponda P. Age-induced apoptosis in the male genital tract of the mouse. Reproduction 2004;127(3):359–366. doi.org/10.1530/ rep.1.00092.
- La Vignera S, Condorelli RA, Russo GI, Morgia G, Calogero AE. Endocrine control of benign prostatic hyperplasia. Andrology 2016;4(3):404–411. doi: 10.1111/ andr.12186.
- Wu Y, Pan H, Wang W-M, Xu D, Zhang L, Gu Z-Q. et al. A possible relationship between serum sex hormones and benign prostatic hyperplasia/lower urinary tract symptoms in men who underwent transurethral prostate resection. Asian J Androl 2017;19(2):230–233. doi: 10.4103/1008-682X.171575.
- Aucamp J, Bronkhost AJ, Badenhorst CPS, Pretorius RJ. The diverse origins of circulating cell-free DNA in the human body: a critical re-evaluation of the literature. Biolog Rev Camb Philos Soci 2018;93(3):1649–1683. doi: 10.1111/brv.12413.
- Mittra I, Khare NK, Raghuram GV, Chaubal R, Khambatti F. et al. Circulating nucleic acids damage DNA of healthy cells by integrating into their genomes. J Biosci 2015;40(1): 91-111. doi: 10.1007/s12038-015-9508-6.
- Gregory CD, Paterson M. An apoptosis-driven ‘onco-regenerative niche’: roles of tumour-associated macrophages and extracellular vesicles. Philosophical Transactions of the Royal Society B: Biolog Sci 2017;373:1737. doi: 10.1098/ rstb.2017.0003.
- Беспалов В.Г., Кужанов А.А., Васильева И.Н., Семенов А.Л., Александров В.А. Взаимосвязь между доброкачественной гиперплазией и раком предстательной железы: новые возможности для химиопрофилактики рака простаты. Вопросы онкологии 2016;62(2):360-371. [Bespalov V.G., Kuzhanov A.A., Vasilieva I.N., Semenov A.L., Alexandrov V.A. Relationship between benign prostatic hyperplasia and prostate cancer: new opportunities for prostate cancer chemoprevention. Voprosy oncologii = Guestions Oncology 2016;62(2):360-361 (In Russian)].
- Glass AS, Porten SP, Bonham M, Tran TC, Cowan JE, Punnen S. et al. Active surveillance: does serial prostate biopsy increase histological inflammation? Prostate Cancer Prostatic Dis 2013;16(2):165–169. doi: 10.1038/pcan.2012.51.
Статья опубликована в журнале “Экспериментальная и клиническая урология” №3 2019, стр. 26-31