Перспективы системной энзимотерапии при мужском иммунном бесплодии
С.Н. Калинина, Д.Г. Кореньков, В.Н. Фесенко, Т.Н. Назаров
ФГБОУ ВПО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России;
Россия, 191015 Санкт-Петербург, ул. Кирочная, 41
Контакты: Светлана Николаевна Калинина Kalinina_sn@mail.ru
Введение
В настоящее время актуальной проблемой остается сохранение репродуктивного здоровья мужчин фертильного возраста, поскольку принимаемые действующей системой здравоохранения меры недостаточны [1]. Под бесплодием понимают ненаступление беременности в течение 1 года у женщины в сексуально активной паре, не использующей противозачаточные средства. На данный момент в среднем каждая 7-я пара в мире бесплодна, и в половине случаев это обусловлено нарушением репродуктивной функции мужчины [2–10]. Около 15 % пар в связи с ненаступлением беременности в течение 1 года нуждаются в медицинской помощи, причем в половине случаев по поводу мужского бесплодия [11]. По данным Всемирной организации здравоохранения (ВОЗ), в последнее время заметна общая тенденция к снижению качества фертильного эякулята; особенное внимание привлекает плохое качество сперматозоидов, которое становится причиной не только отсутствия беременности, но и нарушений развития плода, врожденных аномалий у детей [3, 4]. По статистике, в России около 17 % браков являются бесплодными, и каждая 6-я супружеская пара сталкивается с трудностями при попытках зачатия в тот или иной период.
Мужское бесплодие – многофакторное заболевание, при котором нарушаются не только половая, репродуктивная, гормональная, копулятивная функции, но и работа нервной, кровеносной, иммунной систем [5]. К этиопатогенетическим факторам снижения мужской фертильности эксперты Европейской ассоциации урологов (European Association of Urology) относят: аномалии мочеполовых органов, злокачественные опухоли, инфекции мочеполовой системы, варикоцеле, генетические и иммунологические нарушения [5]. Эксперты ВОЗ считают факторами риска нарушения мужской фертильности воспалительные заболевания добавочных половых желез (простатиты, эпидидимиты), обусловленные инфекциями, передаваемыми половым путем (ИППП), которые влияют на секреторную функцию добавочных половых желез, снижают выработку лимонной кислоты, фосфотазы, цинка, фруктозы и приводят к секреторному, экскреторному, иммунному мужскому бесплодию, нарушению гематотестикулярного барьера и выработке антиспермальных антител (АСА), что требует длительного лечения, иногда с использованием вспомогательных репродуктивных технологий (ВРТ) [12–14]. Микроорганизмы при заболеваниях, передаваемых половым путем, выходят в клеточное пространство, достигают тазовых, преаортальных лимфатических узлов, контактируют с лимфоцитами периферической крови, адсорбируются на мембранах клеток эпителия, сперматозоидах, проникают в секрет предстательной железы (ПЖ), повышают уровень АСА в эякуляте, сыворотке крови, ухудшая сперматологические, репродуктивные показатели, но эти нарушения при лечении потенциально устранимы. Фактором риска развития мужского бесплодия при инфекционно-воспалительном процессе некоторые авторы считают присутствие в сперме Escherichia coli, Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, вируса герпеса, которые нарушают равновесие между процессами активации и апоптоза лейкоцитов в репродуктивной системе мужчины. Другим фактором риска называют гиперпродукцию активных форм кислорода, что приводит к нарушению дренажной функции семенных пузырьков, фиброзу ПЖ [15, 16].
Один из известных иммунологических факторов, препятствующих оплодотворению, – повышенная продукция АСА. Они усиливают агглютинацию сперматозоидов и склеивают их головки, что препятствует их продвижению через канал шейки матки и блокирует капацитацию [17–21]. Повышенная продукция АСА может быть связана с наличием воспалительных процессов в женском генитальном тракте. АСА – это группа антител к антигенам мембраны и различным органеллам сперматозоидов; они выявляются у 7– 15 % бесплодных мужчин, причем чаще в эякуляте (класса IgG), чем в сыворотке крови (классов IgG и IgM). АСА покрывают различные части сперматозоида и нарушают его подвижность. АСА класса IgG появляются в семенной жидкости вследствие транссудации из системы циркуляции крови в ПЖ, а АСА классов IgA и IgM возникают в результате интратестикулярного и/или эпидидимального синтеза. Ухудшение проницаемости гематотестикулярного барьера, образованного собственной оболочкой семенных канальцев и цитоплазмой клеток Сертоли, ведет к высокому содержанию в сперме АСА к сперматогенному эпителию семенных канальцев уже на последней стадии сперматогенеза (стадии образования сперматид, сперматозоидов). АСА блокируют эти клетки, нарушают их трофику и в дальнейшем подвижность сперматозоидов, препятствуют их проникновению в цервикальную слизь, ухудшают фертильность, что требует длительного лечения, иногда с привлечением ВРТ [22, 23]. Если более 50 % сперматозоидов покрыты АСА, то правомочна постановка диагноза мужского иммунного бесплодия, особенно при отсутствии беременности в паре в течение 1 года половой жизни без контрацепции. Определение уровня АСА входит в перечень тестов для диагностики мужского и женского бесплодия.
Все вышеперечисленное снижает концентрацию сперматозоидов, ухудшает их подвижность и морфологию, приводит к их агглютинации, ослабляет их способность проникать в яйцеклетку и оплодотворять ее [22, 24].
Лечение мужского иммунного бесплодия остается сложной задачей. Важно устранить этиологические и патогенетические факторы развития аутоиммунных процессов в половой системе мужчины: ИППП, воспалительные заболевания мужских половых органов на фоне этих инфекций, варикоцеле, переохлаждение и перегревание, орхит, травмы органов мошонки, обструкцию семявыносящих протоков, производственные вредности, женский иммунный фактор [25]. Однако иногда даже при устранении этиопатогенетических факторов трудно остановить аутоиммунный процесс, поэтому необходимы лекарственные средства или ВРТ: экстракорпоральное оплодотворение, интрацитоплазматическая инъекция сперматозоида в яйцеклетку и др. При покрытии АСА более чем 50 % сперматозоидов в эякуляте беременность будет затруднена, но, по данным исследований, снизить агрессию мужских и женских АСА более чем в 40 % случаев может интрацитоплазматическая инъекция сперматозоида в яйцеклетку. Попытки назначения при мужском иммунном бесплодии гонадотропинов, антиэстрогенов, ингибиторов фосфодиэстеразы 5-го типа, α-адреноблокаторов, растительных препаратов оказались безуспешными; даже кортикостероиды были недостаточно эффективны и вызывали большое количество побочных эффектов. Некоторые авторы отметили положительный эффект высоких доз энзимов (например, 12–18 таблеток «Вобэнзима» в сутки), которые снижали уровень АСА в эякуляте, не вызывая побочных явлений [26].
Проблема лечения мужского иммунного бесплодия сложна, многогранна, недостаточно изучена, фактически является междисциплинарной и находится на стыке урологии, андрологии, микробиологии, эндокринологии, репродуктологии. В настоящее время остается актуальным лечение мужского иммунного бесплодия фармакологическими средствами, которые были бы наиболее безопасны и действенны и не имели бы побочных эффектов. Такими средствами могут быть энзимы. Системная энзимотерапия (СЭТ), внедренная в клиническую практику за рубежом более 25 лет тому назад немецкими учеными М. Вольфом и К. Рансбергером, оказалась востребованной и в нашей стране. Известно свыше 3500 энзимов (протеолитических ферментов), которые представляют собой белковые вещества, синтезируемые любой живой клеткой и служащие биологическими катализаторами. Они присутствуют в крови здоровых людей как факторы защиты, профилактики и оказывают благоприятное влияние на течение многих воспалительных, опухолевых, дегенеративных процессов, которые ускоряют реакции организма и поддерживают жизнь. СЭТ относят к перспективным методам лечения и профилактики широкого спектра заболеваний. Комбинация высокоактивных гидролитических энзимов (ферментов) растительного и животного происхождения действует на физиологические и патофизиологические процессы организма, ослабляя иммунно-воспалительные реакции, в том числе при мужском иммунном бесплодии [27–29].
Всасывание энзимов начинается в тонком кишечнике путем резорбции (пиноцитоза) – это универсальный способ питания растительных и животных клеток. Через межклеточные промежутки энзимы поступают в сосудистую систему. Через специфические энтероциты (М-клетки), макрофаги, Т- и В-лимфоциты, которые контролируют энзимные комплексы, обладающие чужеродными для организма антигенными свойствами, энзимы воздействуют на иммунитет, реологические свойства крови, метаболизм и гомеостаз в целом. В дальнейшем энзимы, проходя по сосудам, накапливаются в зоне патологического процесса, оказывают иммуномодулирующее, противовоспалительное, фибринолитическое, противоотечное, антиагрегантное и вторично-анальгезирующее действие.
Одними из лекарственных препаратов для СЭТ являются «Вобэнзим», «Флогэнзим» (Мукос Фарма, Германия). Эти препараты представляют собой комплекс протеолитических ферментов, состоящий из энзимов растительного (папаин, бромелаин) и животного (трипсин, липаза, амилаза, химотрипсин, панкреатин, рутин) происхождения. Они оказывают иммуномодулирующее действие и показаны при ИППП и их осложнениях: простатитах, везикулитах, эпидидимитах, мужском иммунном бесплодии. Они снижают концентрацию провоспалительных и противовоспалительных цитокинов, устраняют иммунодефицитные и аутоиммунные состояния, удаляют из кровотока иммунные комплексы, токсины, образующиеся при воспалительном процессе, регулируют обменные процессы, улучшают эластичность кровеносных сосудов, повышают проницаемость капиллярных мембран. Достоинства этих препаратов – доказанные 60-летним опытом применения эффективность и безопасность. Эти препараты не обладают токсичными, тератогенными, мутагенными свойствами, не вызывают привыкания, синдрома отмены, не угнетают выработку собственных ферментов организма, не требуют лабораторного контроля и совместимы с различными лекарственными препаратами. Энзимы противопоказаны при гемофилии, тромбоцитопении, индивидуальной непереносимости любого из компонентов препарата. Из побочных эффектов отмечают послабление стула, метеоризм, чувство переполнения желудка, аллергические реакции.
В последние годы акцентируется внимание на роли окислительного стресса в формировании мужского бесплодия. По данным научной литературы, одним из патогенетических факторов риска снижения мужской фертильности, является гиперпродукция активных форм кислорода, к которым относят оксид азота и свободные радикалы, повреждающие ДНК хромосом и мембраны сперматозоидов, инициирующие их апоптоз, что приводит к снижению концентрации сперматозоидов, ухудшению их подвижности и оплодотворяющей способности, чтоиназывают окислительным стрессом сперматозоидов. Частота окислительного стресса варьирует от 30 до 80 %. Антиоксидантными свойствами обладают витамины А, Е, С, микроэлементы селен и цинк, карнитины, пентоксифиллин, растительные биофлавоноиды [30, 31]. По данным M.G. Showell и соавт., эффективность антиоксидантных препаратов зависит от их качественного и количественного состава. Эти авторы выполнили анализ результатов 48 исследований (с участием 4179 субфертильных мужчин), в которых сравнивали монокомпонентные и комбинированные антиоксиданты между собой, с плацебо и отсутствием лечения. Авторы сделали вывод, что антиоксиданты могут повысить эффективность прегравидарной подготовки у субфертильных мужчин. Они считают, что антиоксиданты должны назначаться с определенной осторожностью и что необходимы дальнейшие исследования для выбора оптимального препарата. Вероятность наступления клинической беременности при отсутствии приема антиоксидантов составляла 6 %, а после приема антиоксидантов варьировала от 11 до 28 % [32]. Некоторые авторы для профилактики и лечения мужского бесплодия, вызванного окислительным стрессом, часто применяют в режиме монотерапии или в комбинации с антиоксидантами цинк, селен, фолиевую кислоту, витамины Е, С, карнитины, N-ацетил-L-цистеин, коэнзим Q10 и ликопин [33–35].
В состав многокомпонентной биологически активной добавки к пище «Спермстронг» («ВИС», Россия) входят 10 компонентов, обладающих синергизмом и антиоксидантными свойствами: L-аргинин, L-карнитин, экстракт астрагала, селен, витамины С, Е, В5 , В6 , сульфат цинка, глюконат марганца, которые могут улучшить сперматологические показатели бесплодного мужчины: увеличить концентрацию сперматозоидов, повысить их подвижность и оплодотворяющую способность, усилить кровоток в органах малого таза, а также защитить от повреждающего действия свободных радикалов. Этот антиоксидантный комплекс может снизить риск окислительного стресса сперматозоидов, стимулируя сперматогенез.
Цель исследования – оценить эффективность и безопасность лекарственных препаратов «Вобэнзим», «Флогэнзим» в комбинации с биологически активной добавкой к пище «Спермстронг» в лечении иммунного бесплодия.
Материалы и методы
Пациенты были обследованы в консультативнодиагностическом центре урологической клиники Северо-Западного государственного медицинского университета им. И.И. Мечникова, расположенном в Александровской больнице (которая является базой кафедры урологии того же университета), и в прикрепленных поликлиниках с декабря 2018 г. по сентябрь 2019 г. В исследование вошли 64 бесплодных мужчины в возрасте от 23 до 45 лет (средний возраст 34 года), которые жаловались на ненаступление у жены или сексуальной партнерши беременности в течение срока от 1 до 3–5 лет и нарушение параметров спермограммы, повышение в эякуляте и сыворотке крови уровня АСА. Все пациенты ранее лечились в различных медицинских учреждениях по поводу хронического простатита, хронического эпидидимита, обусловленных хламидийной, микоплазменной, уреаплазменной, герпетической инфекцией, которая перед настоящим исследованием была исключена. Жены и половые партнерши одновременно проходили обследование и лечение в женских консультациях.
Критерии включения: возраст от 23 до 45 лет, бесплодие в браке в течение 1–5 лет, наличие изменений в спермограмме, отсутствие ИППП, патогенной микрофлоры в уретре, секрете ПЖ или в средней порции мочи после массажа, эякуляте, отсутствие лейкоцитоспермии, нормальное содержание лейкоцитов в секрете ПЖ, наличие АСА в эякуляте и сыворотке крови, отсутствие дефицита андрогенов.
Критерии исключения: наличие ИППП, заболеваний, передаваемых половым путем (простатит, эпидидимит, уретрит), венерических болезней, гипогонадизма, отита, крипторхизма, камней в ПЖ, концентрация сперматозоидов <5 млн/мл, наличие обструктивной азооспермии, аномалий половых органов (отсутствие ductus deferens), стриктур уретры, травмы органов мошонки, варикоцеле, уровень простатического специфического антигена >4 нг/мл, наличие сахарного диабета, психических заболеваний, прием гормональных препаратов.
Пациенты были распределены по 2 группам. В 1-ю группу вошли 32 (50 %) пациента, которым была назначена комбинированная терапия: СЭТ + прием «Спермстронга». В первые 2 нед лечения эти пациенты принимали препарат «Вобэнзим» перорально по 5 драже 3 раза в день и препарат «Флогэнзим» по 3 драже 3 раза в день, далее в течение 6 нед – «Вобэнзим» по 3 драже 3 раза в день и «Флогэнзим» по 2 драже 3 раза в день. Одновременно в течение 8 нед они принимали «Спермстронг» по 1 капсуле 2 раза в день. Во 2-ю группу вошли 32 (50 %) пациента, которые принимали только «Спермстронг» в аналогичной дозе в течение 8 нед. На период лечения супружеским парам рекомендовали применять презерватив во время полового акта, чтобы создать барьер между спермой (сперматозоидами) и влагалищным, шеечным секретом (яйцеклеткой) во избежание попадания АСА.
Все пациенты проходили клиническое обследование, включающее сбор анамнеза (данных о длительности бесплодия, первичного или вторичного, ранее перенесенных заболеваниях, операциях, травмах, возрасте супруги, половой партнерши, состоянии ее репродуктивной системы, профессиональных и других вредностях), общий осмотр, физикальное обследование. Проводили общий анализ мочи, клинический и биохимический анализ крови (с определением уровня холестерина, глюкозы, половых и гонадотропных гормонов (фоликулостимулирующего, лютеинизирующего, общего тестостерона, пролактина, эстрадиола, тироксина), простатического специфического антигена. Эякулят исследовали с помощью счетной камеры Маклера в соответствии с руководством ВОЗ 2010 г., включая определение макро- и микроскопических показателей до, в процессе и после лечения: объема, концентрации, подвижности, морфологии сперматозоидов, наличия их агглютинации, количества лейкоцитов. Определяли содержание сперматозоидов, покрытых АСА класса IgG, в эякуляте с помощью MAR-теста (норма 0,0– 50,0 %), а также содержание АСА классов IgG/IgM (обладающих более высокой агглютинирующей способностью по сравнению с АСА класса IgА) в сыворотке крови методом иммуноферментного анализа (норма 0,0–150,0 МЕ/мл).
Перед лечением у всех пациентов исключены ИППП, патогенная и условно-патогенная микрофлора в клиническом материале, полученном из уретры, в бактериологических посевах средней порции мочи после массажа ПЖ, в секрете ПЖ, эякуляте методом полимеразной цепной реакции в реальном времени. Выполняли пальцевое ректальное исследование ПЖ, трансректальное ультразвуковое исследование ПЖ с доплерографией и ультразвуковое исследование органов мошонки. Микроскопическое исследование секрета ПЖ, эякулята проводили с помощью бинокулярного микроскопа при увеличении в 400 раз. У некоторых жен, сексуальных партнерш пациентов для определения пенетрационной совместимости брали пробу Шуварского–Симса–Хунера (посткоитальный тест): исследовали секрет шейки матки через 2–4 ч после коитуса в дни, предшествующие овуляции. Результат пробы считали положительным, если микроскопически определяли до 20–25 слабоподвижных сперматозоидов, отрицательным – если сперматозоиды присутствовали, но были неподвижными. Пробу Курцрока–Миллера выполняли в овуляторный период (каплю спермы мужа и каплю секрета шейки матки покрывали покровным стеклом так, чтобы они только соприкасались, и проводили микроскопию). Результат пробы считали положительным, если сперматозоиды проникали через границу биологических жидкостей, но слабо двигались, отрицательным – если сперматозоиды проникали в секрет шейки матки, но в течение 2 ч были неподвижными. У некоторых пациентов 1-й и 2-й групп исследовали клеточный и гуморальный иммунитет, интерфероновый статус. У всех пациентов получено информированное согласие на участие в исследовании
Для математической обработки данных использовалась программа Microsoft Excel 2013. Результаты были обработаны общепринятыми статистическими методами с вычислением среднего значения и его ошибки, доверительного интервала при доверительной вероятности α = 0,95 (вероятность ошибки р ˂0,05). В целях проверки статистической значимости различий между выборками вычисляли t-критерий Стьюдента.
Результаты У всех пациентов до лечения уровень половых и гонадотропных гормонов находился в пределах нормы. В секрете ПЖ, эякуляте наблюдалось нормальное содержание лейкоцитов с незначительным уменьшением числа лецитиновых зерен. Уровень простатического специфического антигена у пациентов обеих групп был ниже 2 нг/мл.
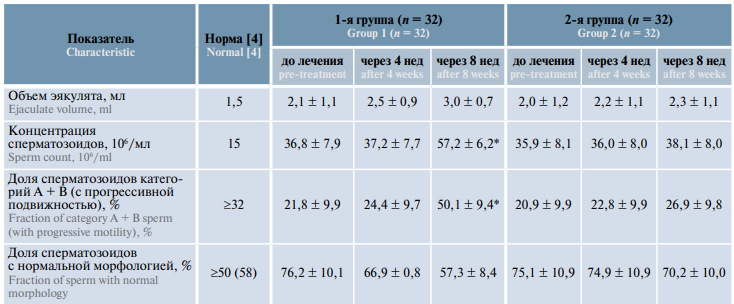
На фоне проведенного лечения в группе пациентов, проходивших комбинированную терапию («Вобэнзим», «Флогэнзим» + «Спермстронг»), статистически значимо увеличился объем эякулята – с 2,1 до 2,5 мл (+19,0 %) через 4 нед лечения и до 3,0 мл (+42,9 %) через 8 нед. В группе пациентов, принимавших только «Спермстронг», объем эякулята увеличился в меньшей степени – с 2,0 до 2,2 мл (+10,0 %) через 4 нед и до 2,3 мл (+15,0 %) через 8 нед (табл. 1, рис. 1).
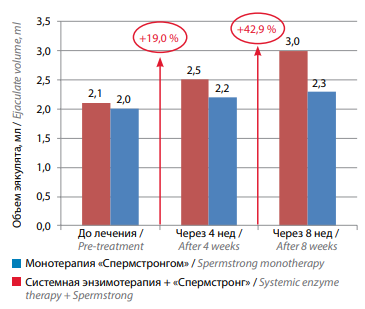
Рис. 1. Изменение объема эякулята на фоне лечения у мужчин с бесплодием, принимавших биологически активную добавку «Спермстронг» в режиме монотерапии и в сочетании с системной энзимотерапией
Fig. 1. Changes in ejaculate volume during treatment in males with infertility receiving Spermstrong dietary supplement as monotherapy or in combination with systemic enzyme therapy
После комбинированной терапии («Вобэнзим», «Флогэнзим» + «Спермстронг») средняя концентрация сперматозоидов увеличилась с 36,8 до 37,2 млн/мл (+1,1 %) через 4 нед и до 57,2 млн/мл (+55,4 %) через 8 нед. Вгруппе пациентов, принимавших только «Спермстронг», значительного повышения этого показателя не наблюдалось: исходный уровень – 35,9 млн/мл, через 4 нед – 36,0 млн/мл (+0,3 %), через 8 нед – 38,1 млн/мл (+6,1 %). Статистически значимым было увеличение средней концентрации сперматозоидов только в 1-й группе пациентов после 8 нед лечения (p <0,05) (рис. 2).
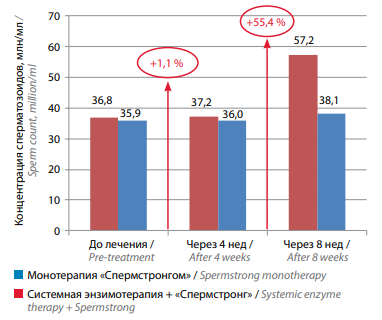
Рис. 2. Изменение концентрации сперматозоидов на фоне лечения у мужчин с бесплодием, принимавших биологически активную добавку «Спермстронг» в режиме монотерапии и в сочетании с системной энзимотерапией
Fig. 2. Changes in sperm count during treatment in males with infertility receiving Spermstrong dietary supplement as monotherapy or in combination with systemic enzyme therapy
Улучшение подвижности сперматозоидов было более выраженным у пациентов 1-й группы: доля подвижных сперматозоидов составила до начала лечения 21,8 %, через 4 нед – 24,4 % (+11,9 %), через 8 нед – 50,1 % (+129,8 %), т. е. увеличилась в 2,5 раза (табл. 1, рис. 3).
Таблица 1. Динамика сперматологических показателей мужчин с бесплодием, принимавших биологически активную добавку «Спермстронг» в режиме монотерапии и в сочетании с системной энзимотерапией, M ± m
Table 1. Dynamics of sperm characteristics in males with infertility receiving Spermstrong dietary supplement as monotherapy or in combination with systemic enzyme therapy, M ± m
*Различия с показателями до лечения статистически значимы (p <0,05).
*Significant difference compared to pre-treatment values (p <0.05).
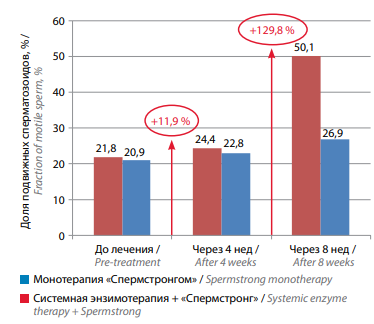
Рис. 3. Изменение доли подвижных сперматозоидов на фоне лечения у мужчин с бесплодием, принимавших биологически активную добавку «Спермстронг» в режиме монотерапии и в сочетании с системной энзимотерапией
Fig. 3. Changes in fraction of motile sperm in males with infertility receiving Spermstrong dietary supplement as monotherapy or in combination with systemic enzyme therapy
В 1-й группе уменьшение доли патологически измененных форм сперматозоидов происходило несколько быстрее, чем во 2-й группе. Этот показатель до начала лечения превышал норму и составлял 76,2 %, через 4 нед он уменьшился до 66,9 % (−12,2 %), а через 8 нед снизился до допустимой нормы 57,3 % (−24,8 %); во 2-й группе исходно этот показатель составлял 75,1 %, через 4 нед – 74,9 % (−0,3 %), а через 8 нед он снизился только до 70,2 % (−6,5 %) (рис. 4).
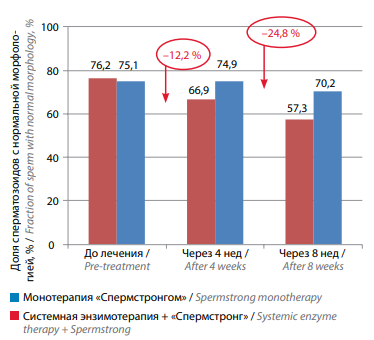
Рис. 4. Изменение доли сперматозоидов с нормальной морфологией на фоне лечения у мужчин с бесплодием, принимавших биологически активную добавку «Спермстронг» в режиме монотерапии и в сочетании с системной энзимотерапией
Fig. 4. Changes in fraction of sperm with normal morphology in males with infertility receiving Spermstrong dietary supplement as monotherapy or in combination with systemic enzyme therapy
Пробы Шуварского–Симса–Хунера и Курцрока– Миллера до лечения у 20 пациентов обеих групп давали слабоположительный результат, т.е. при микроскопии в посткоитальной шеечной слизи обнаружено до 15 слабоподвижных сперматозоидов, и не все они проникали через границу спермы и секрета шейки матки. До начала лечения в эякуляте пациентов обеих групп выявлена агглютинация сперматозоидов.
Уровень АСА класса IgG у пациентов, проходивших комбинированную терапию («Вобэнзим», «Флогэнзим» + «Спермстронг»), до начала лечения составлял 25,1 %, а через 4 нед снизился до 18,5 % (–26,3 %), через 8 нед – до 10,3 % (–59,0 %), т.е. более чем в 2 раза. В группе пациентов, принимавших только «Спермстронг», средний уровень АСА класса IgG в эякуляте до начала лечения составлял 23,5 %, через 4 нед снизился незначительно – до 22,7 % (–3,4 %), через 8 нед – до 20,4 % (–13,2 %) (табл. 2, на рис. 5а).
Таблица 2. Динамика уровня антиспермальных антител в эякуляте и сыворотке крови мужчин с бесплодием, принимавших биологически активную добавку «Спермстронг» в режиме монотерапии и в сочетании с системной энзимотерапией, M ± m
Table 2. Dynamics of antisperm antibodies in the ejaculate and serum of males with infertility receiving Spermstrong dietary supplement as monotherapy or in combination with systemic enzyme therapy, M ± m
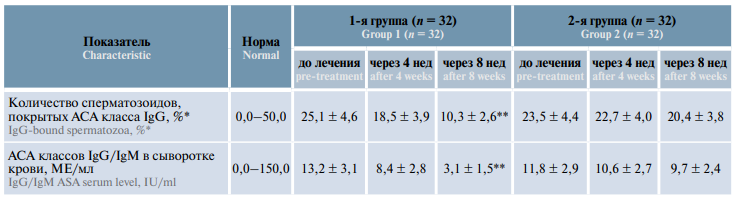
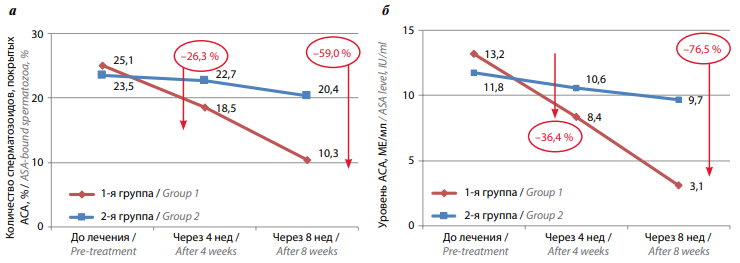
Рис. 5. Динамика уровня антиспермальных антител (АСА) в эякуляте (а) и сыворотке крови (б) у мужчин с бесплодием, принимавших биологически активную добавку «Спермстронг» в режиме монотерапии и в сочетании с системной энзимотерапией
Fig. 5. Dynamics of antisperm antibodies in the ejaculate (а) and serum (б) of males with infertility receiving Spermstrong dietary supplement as monotherapy or in combination with systemic enzyme therapy
Средний уровень АСА классов IgG/IgM в сыворотке крови в группе пациентов, проходивших комбинированную терапию («Вобэнзим», «Флогэнзим» + «Спермстронг»), до начала лечения составлял 13,2 МЕ/мл, через 4 нед снизился до 8,4 МЕ/мл (–36,4 %), через 8 нед – до 3,1 МЕ/мл (–76,5 %), т. е. в 4 раза. У пациентов, принимавших только «Спермстронг», уровень АСА классов IgG/IgM в сыворотке крови до начала лечения составлял 11,8 МЕ/мл, через 4 нед умеренно снизился до 10,6 МЕ/мл (–10,2 %), через 8 нед – до 9,7 (–17,8 %) МЕ/мл (табл. 2, рис. 5б). Статистически значимыми оказались различия уровня АСА в эякуляте и сыворотке крови до начала лечения, через 4 нед и через 8 нед лишь в группе пациентов, проходивших комбинированное лечение («Вобэнзим», «Флогэнзим» + «Спермстронг») (p <0,05).
У пациентов, принимавших только «Спермстронг», высокое содержание АСА выявлено как в эякуляте, так и в сыворотке крови, т.е. у них сохранялось нарушение гематотестикулярного барьера, и поэтому им были рекомендованы ВРТ.
До лечения у части пациентов 1-й и 2-й групп в иммунограмме определено снижение уровня Т-хелперов, цитотоксических Т-лимфоцитов, повышение содержания циркулирующих иммунных комплексов и иммуноглобулинов IgG. После окончания лечения у пациентов, получавших комбинацию препаратов «Вобэнзим», «Флогэнзим» и «Спермстронг», отмечено улучшение этих показателей.
При пальцевом ректальном исследовании у больных обеих групп ПЖ была безболезненной с участками рубцевания. По данным трансректального ультразвукового исследования и доплерографии до лечения ПЖ была диффузно-неоднородной консистенции с гипер- и гипоэхогенными участками, несколько уменьшена в объеме (до 18–19 см3 ) с некоторым ослаблением кровотока в субкапсулярных и парауретральных артериях. Через 8 нед после комбинированного лечения у всех пациентов 1-й группы наблюдалось увеличение участков ПЖ с однородной структурой, значительное (>50 %) уменьшение гиперэхогенных образований и улучшение кровотока в сосудах ПЖ. После лечения в обеих группах отмечено увеличение количества лецитиновых зерен в секрете ПЖ и эякуляте, что свидетельствовало об улучшении функциональной способности ПЖ. При осмотре и пальпации органов мошонки до лечения мы не обнаруживали признаков гипогонадизма и варикозно расширенных вен семенного канатика у пациентов обеих групп, но у отдельных пациентов отметили некоторое снижение тургора мошонки, пастозность яичек и придатков, что, вероятно, было связано с перенесенными ранее эпидидимитами, вызванными ИППП.
По результатам ультразвукового исследования яички и придатки были нормальных размеров (до 38–43 мм) с ровными контурами, мелкозернистой структурой, а у единичных пациентов выявлены небольшие кисты в головке придатка яичка диаметром <0,3 см, не требующие оперативного лечения. По данным доплерографии органов мошонки у некоторых пациентов обеих групп до лечения в тестикулярных артериях наблюдалось незначительное снижение скорости кровотока, что, видимо, связано с ранее перенесенными заболеваниями добавочных половых желез, вызванными ИППП. Через 8 нед после лечения, особенно у пациентов 1-й группы, увеличилась скорость кровотока в тестикулярных артериях
Итак, в результате 8-недельного курса лечения произошло значительное улучшение сперматологических показателей у пациентов, прошедших комбинированное лечение («Вобэнзим», «Флогэнзим» + «Спермстронг»): увеличился объем эякулята, концентрация сперматозоидов, повысилась их подвижность, уменьшилось количество сперматозоидов с аномальной морфологией, снизился уровень АСА в эякуляте и сыворотке крови. Эти изменения были более выраженными, чем во 2-й группе. Пациентам 2-й группы рекомендовано применение ВРТ, эфферентных методов. После лечения у жен 5 пациентов 1-й группы наступила беременность. Ни у одного пациента в обеих группах не наблюдалось побочных реакций.
Обсуждение
Результаты нашего исследования подтверждают эффективность и хорошую переносимость, безопасность лекарственных препаратов для СЭТ «Вобэнзим», «Флогэнзим» в сочетании с биологически активной добавкой к пище «Спермстронг» в лечении мужского иммунного бесплодия. Эффективность комбинированного лечения возрастала благодаря содержанию достаточного количества компонентов и их синергического действия, что восстанавливало нарушенный гематотестикулярный барьер, снижало уровень АСА в эякуляте, сыворотке крови, уменьшало количество морфологически измененных форм, увеличивало концентрацию сперматозоидов и повышало их подвижность, капацитацию, улучшало кровоснабжение в ПЖ, яичках, репродуктивные показатели супружеской пары. В группе пациентов, принимавших только «Спермстронг», были отмечены некоторые улучшения параметров эякулята, но они носили невыраженный характер. Эффективность комплекса «Спермстронг» в лечении мужского иммунного бесплодия не была подтверждена в нашем исследовании, его применение не снижало уровень АСА в эякуляте, сыворотке крови, что ухудшало иммунологический компонент нарушений мужской фертильности.
Заключение
В настоящем исследовании подтверждена эффективность протеолитических ферментов в лечении мужского иммунного бесплодия, вызванного образованием АСА. Ферменты обладают способностью снижать уровень АСА в эякуляте, сыворотке крови. Применение комбинированной терапии, содержащей протеолитические ферменты в сочетании с антиоксидантом, можно рекомендовать для лечения мужского иммунного бесплодия, вызванного образованием АСА и другими сперматологическими нарушениями. Продолжительность такой терапии должна составлять не менее 2 мес.
Литература
- Глобальная стратегия сектора здравоохранения по инфекциям, передаваемым половым путем, на 2016–2021 гг.: на пути к ликвидации ИППП. Женева: ВОЗ, 2016. 60 с. Доступно по: https://www.who.int/reproductivehealth/ publications/rtis/ghss-stis/ru. [Global health sector strategy on sexually transmitted infections, 2016–2021. Geneva: WHO, 2016. 60 p. (In Russ.). Available at: https://www.who.int/ reproductivehealth/publications/rtis/ ghss-stis/ru].
- Урология. Российские клинические рекомендации. Под ред. Ю.Г. Аляева, П.В. Глыбочко, Д.Ю. Пушкаря. М.: Медфорум, 2018. 544 с. [Urology. Russian clinical guidelines. Ed. by Yu.G. Alyaev, P.V. Glybochko, D.Yu. Pushkar. Moscow: Medforum, 2018. 544 p. (In Russ.)].
- WHO manual for the standardized investigation, diagnosis and management of the infertile male. Cambridge: Cambridge University Press, 2000. 91 p.
- WHO laboratory manual for the examination and processing of human semen. Geneva: WHO, 2010. 271 p.
- Guidelines on male infertility. Ed. by A. Jungwirth. European Association of Urology, 2017. Pp. 65–69.
- Andrology: male reproductive health and dysfunction. Ed. by E. Nieschlag, H.M. Behre, S. Nieschlag 3rd edn. Berlin; Heidelberg: Springer-Verlag, 2010. 629 p.
- Krausz C., Escamilla A.R., Chianese C. Genetics of male infertility: from research to clinic. Reproduction 2015;150(5):R159–74. DOI: 10.1530/REP-15-0261.
- Андрология. Фармакотерапия без ошибок. Руководство для врачей. Под ред. А.А. Камалова. М.: Е-ното, 2017. 384 с. [Andrology. Pharmacotherapy without errors. A guide for physicians. Ed. by A.A. Kamalov. Moscow: E-Noto, 2017. 384 p. (In Russ.)].
- Сухих Г.Т., Божедомов В.А. Мужское бесплодие. Практическое руководство для урологов и гинекологов. М.: Эксмо, 2009. 240 с. [Sukhih G.T., Bozhedomov V.A. Male infertility. Guide for urologists and gynecologists. Moscow: Eksmo, 2009. 240 p. (In Russ.)].
- Тиктинский О.Л., Калинина С.Н., Михайличенко В.В. Андрология. М.: МИА, 2010. 576 с. [Tiktinskiy O.L., Kalinina S.N., Mikhaylichenko V.V. Andrology. Moscow: MIA, 2010. 576 p. (In Russ.)].
- Божедомов В.А. Мужской фактор бездетного брака – пути решения проблемы. Урология 2016;(1-S1):28–34. [Bozhedomov V.A. The male factor in childless marriage – problem-solving strategies. Urologiya = Urology 2016;(1-S1):28–34. (In Russ.)].
- Божедомов В.А., Семенов А.В., Конышев А.В. и др. Репродуктивная функция мужчин при хроническом простатите: клинико-анамнестические и микробиологические аспекты. Урология 2015;(1):70–8. [Bozhedomov V.A., Semenov A.V., Konyshev A.V. et al. Reproductive function in men with chronic prostatitis: clinical, disease history and microbiological risk aspects. Urologiya = Urology 2015;(1):70–8. (In Russ.)].
- Radonić A., Kovacević V., Markotić A. et al. The clinical significance of Ureaplasma urealyticum in chronic prostatitis. J Chemother 2009;21(4):465–6. DOI: 10.1179/joc.2009.21.4.465.
- Haidl G., Allam J.P., Schuppe H.C. Chronic epididymitis: impact on semen parameters and therapeutic options. Andrologia 2008;40(2):92–6. DOI: 10.1111/j.1439-0272.2007.00819.x.
- Калинина С.Н., Тиктинский О.Л. Лечение хронического простатита, обусловленного хламидийной и уреаплазменной инфекцией и осложненного мужским бесплодием. Урология 2010;(3):52–7. [Kalinina S.N., Tiktinskiy O.L. Treatment of chronic prostatitis caused by chlamydia and ureaplasma infection and complicated by male infertility. Urologiya = Urology 2010;(3):52–7. (In Russ.)].
- Alshahrani S., McGill J., Agarwal A. Prostatitis and male infertility. J Reprod Immunol 2013;100(1):30–6. DOI: 10.1016/j.jri.2013.05.004.
- Huang C., Zhu H.L., Xu K.R. et al. Mycoplasma and ureaplasma infection and male infertility: a systematic review and meta-analysis. Andrology 2015;3(5):809–16.
- Alshahrani S., McGill J., Agarwal A. Prostatitis and male infertility. J Reprod Immunol 2013;100(1):30–6.
- Калинина С.Н., Тиктинский О.Л., Александров В.П. Клинико-иммунологические нарушения у больных хроническим простатитом, обусловленным урогенитальной инфекцией. Урология 2006;(3):74–9. [Kalinina S.N., Tiktinskiy O.L., Aleksandrov V.P. Clinical and immunological disorders in patients with chronic prostatitis caused by urogenital infection. Urologiya = Urology 2006;(3):74–9. (In Russ.)].
- Калинина С.Н. Воспалительные заболевания добавочных половых желез у мужчин, обусловленные урогенитальной скрытой инфекцией и осложненные бесплодием. Дис. … д-ра мед. наук. Санкт-Петербург, 2003. 530 с. [Kalinina S.N. Inflammatory diseases of the accessory sex glands in men caused by urogenital latent infection and complicated by infertility. Dis. … of doctor of med. sciences. Saint Petersburg, 2003. 530 p. (In Russ.)].
- Дранник Г.Н. Клиническая иммунология и аллергология. М.: Медицинское информационное агентство, 2003. 603 c. [Drannik G.N. Clinical immunology and allergology. Moscow: Meditsinskoe informatsionnoe agentstvo, 2003. 603 p. (In Russ.)].
- Bozhedomov V.A., Nikolaeva M.A., Ushakova I.V. et al. Functional deficit of sperm and fertility impairment in men with antisperm antibodies. J Reprod Immunol 2015;112:95–101. DOI: 10.1016/j.jri.2015.08.002.
- Jarow J.P., Sanzone J.J. Risk factors for male partner antisperm antibodies. J Urol 1992;148(6):1805–7. DOI: 10.1016/s0022-5347(17)37034-9.
- Божедомов В.А., Теодорович О.В. Эпидемиология и причины аутоиммунного мужского бесплодия. Урология 2005;(1):35–44. [Bozhedomov V.A., Teodorovich О.V. Epidemiology and causes of autoimmune male infertility. Urologiya = Urology 2005;(1):35–44. (In Russ.)].
- Кореньков Д.Г., Марусанов В.Е., Михайличенко В.В., Фесенко В.Н. Аутоиммунное бесплодие у мужчин (этиология, патогенез, диагностика). Учебное пособие. СПб.: Изд-во СЗГМУ им. И.И. Мечникова, 2015. 29 с. [Korenkov D.G., Marusanov V.E., Mikhaylichenko V.V., Fesenko V.N. Autoimmune infertility in men (etiology, pathogenesis, diagnostics). Textbook. Saint Petersburg: Publishing house of the NWSMU n. a. I.I. Mechnikov, 2015. 29 p. (In Russ.)].
- Лоран О.Б., Божедомов В.А., Сухих Г.Т. Современная концепция лечения мужского иммунного бесплодия. Андрология и генитальная хирургия 2000;(1):48–50. [Loran О.B., Bozhedomov V.А., Sukhih G.Т. Modern concept of treatment of male immune infertility. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2000;(1):48–50. (In Russ.)].
- Калинина С.Н., Тиктинский О.Л. Применение Флогэнзима в комплексной терапии у больных бесплодием в браке. Журнал акушерства и женских болезней 2000;49:14–6. [Kalinina S.N., Tiktinsky O.L. Phlogenzyme in complex therapy of infertility in marriage. Zhurnal akusherstva i zhenskih bolezney = Journal of Obstetrics and Women’s Diseases 2000;49:14–6. (In Russ.)].
- Носков Н.Ю. Применение вобэнзима в комплексной терапии больных хроническим простатитом. Нефрология 2004;8(3):84–6. [Noskov N.Yu. Use of vobenzyme in complex therapy of patients with chronic prostatitis. Nefrologiya = Nephrology (Saint Petersburg) 2004;8(3):84–6. (In Russ.)].
- Системная энзимотерапия. Практическое руководство для врачей. Под ред. В.А. Насоновой, С.М. Гавалова. 5-е изд. СПб., 1998. 32 с. [Systemic enzyme therapy. Guide for physicians. Ed. by V.A. Nasonova, S.M. Gavalov. 5th edn. Saint Petersburg, 1998. 32 p. (In Russ.)].
- Божедомов М.В., Торопцева И.В., Ушакова И.В. и др. Активные формы кислорода и репродуктивная функция мужчин: фундаментальные и клинические аспекты (обзор литературы). Андрология и генитальная хирургия 2011;12(3):10–6. [Bozhedomov V.A., Toroptseva M.V., Ushakova I.V. et al. Reactive oxygen species and the reproductive function of men: basic and clinical aspects (review). Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2011;12(3):10–6. (In Russ.)].
- Божедомов В.А., Громенко Д.C., Ушакова И.В. и др. Оксидативный стресс сперматозоидов в патогенезе мужского бесплодия. Урология 2009;(2):51–6. [Bozhedomov V.A., Gromenko D.S., Ushakova I.V. et al. Oxidative stress of sperm in the pathogenesis of male infertility. Urologiya = Urology 2009;(2):51–6. (In Russ.)].
- Showell M.G., Mackenzie-Proctor R., Brown J. et al. Antioxidants for male subfertility. Cochrane Database Syst Rev 2014;(12):CD007411. DOI: 10.1002/14651858.CD007411.pub3.
- Калинина С.Н., Фесенко В.Н., Кореньков Д.Г., Волкова М.В. Диагностика и лечение репродуктивных нарушений у мужчин после перенесенных заболеваний, передаваемых половым путем. Андрология и генитальная хирургия 2017;18(1): 87–98. [Kalininа S.N., Fesenko V.N., Korenkov D.G., Volkova M.V. Diagnosis and treatment of reproductive disorders in men after previous sexually transmitted diseases. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2017;18(1):87–98. (In Russ.)]. DOI: 10.17650/2070-9781-2017-18-1- 87-98.
- Наумов Н.П., Щеплев П.А., Полозов В.В. Роль антиоксидантов в профилактике мужского бесплодия. Андрология и генитальная хирургия 2019;20(1):22–9. [Naumov N.P., Scheplev P.A., Polozov V.V. The role of antioxidants in prevention of male infertility. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2019;20(1):22–9. (In Russ.)].
- Ebisch I.M., Tomas C.M., Peters W.H. The importance of folate, zinc and antioxidants in the pathogenesis and prevention of subfertility. Hum Reprod Update 2007;13(2):163–74. DOI: 10.1093/humupd/dml054.