Гангрена Фурнье. История вопроса, терминология, эпидемиология, предрасполагающие факторы, этиология и патогенез: обзор литературы
А.В. Прохоров
ГБУЗ «Городская клиническая больница № 57» Департамента здравоохранения города Москвы, лечебно-диагностическое подразделение № 1
Гангрена Фурнье (ГФ) относится к редким, недостаточно изученным и, в связи с этим, малознакомым широкому кругу врачей заболеваниям. На сегодняшний день в ресурсах Национального центра биотехнологической информации США (PubMed.gov) насчитывается около 1150 публикаций, объединяющих почти 4000 случаев ГФ. В большинстве своем публикации представлены описанием немногочисленных случаев ГФ (в среднем, 5-7 наблюдений в одной публикации), за исключением около 2-х десятков работ, основанных на ретроспективном анализе крупных серий наблюдений, включающих от 40 и более случаев за длительный период времени (до 15-20 лет) [1-19].
Согласно современным представлениям ГФ является одной из форм быстро прогрессирующего некротизирующего фасциита полимикробной этиологии с преимущественным поражением наружных половых органов, промежности и перианальной области [20-26]. Это острое хирургическое заболевание, требующее неотложных диагностических и лечебных мероприятий. Прогноз при ГФ прежде всего определяется сроками оказания лечебной помощи, задержка в лечебных мероприятиях в течение нескольких часов сопровождается высокой летальностью (от 25% и выше) вследствие развития септического шока [22, 27]. ГФ не имеет возрастных, климатических и географических ограничений [28, 29]. Например, заболеваемость ГФ в США составляет 900-1000 случаев в год, преимущественно среди мужчин социально активного возраста (50-55 лет) [12, 30].
Актуальность заболевания возрастает с каждым годом. Об этом свидетельствуют результаты эпидемиологических исследований последних лет, указывающие на увеличение частоты гнойно-септических поражений мягких тканей в целом, в том числе и ГФ [20, 31]. Полагают, что сложившаяся ситуация связана с ростом числа иммунокомпромиссных пациентов в популяции, которые составляют основной контингент больных ГФ [5, 24, 32]. Кроме того, несмотря на применение современных антибактериальных средств, летальность при ГФ не снижается и остается очень высокой, достигающей по данным отдельных исследований 80% [27, 29].
Лечение пациентов с ГФ сопровождается немалыми экономическими затратами. Cроки госпитализации варьируют от 2 до 278 дней (в среднем, для выживших пациентов – 34,8±18,8 дней, для умерших – 61,6±38,9) [17, 33]. Расходы на лечение одного пациента с ГФ в среднем составляют 27 646 долларов (для выживших больных – 26 574 долларов, для умерших – 40 871) [33]. После выписки из стационара не менее 30% пациентов нуждается в постоянном уходе и более 50% – в повторных реконструктивно-пластических операциях на наружных гениталиях и промежности [24, 31].
За последнее время лет научный интерес к заболеванию значительно возрос. Количество публикаций, посвященных различным аспектам ГФ, за последние 15 лет (2001-2015 гг.) при сравнении с аналогичным периодом конца прошлого века (1986-2000 гг.) увеличилось почти в 1,5 раза. Активно обсуждаются вопросы, связанные, прежде всего, с ранней диагностикой и стратегией лечения ГФ. Изучаются клинико-лабораторные предикторы заболевания, возможности современных лучевых методов исследования (таких как ультрасонография высокого разрешения, компьютерная и магнитно-резонансная томография) в диагностике и определении тактики лечения ГФ. Обсуждаются различные виды и сроки проведения реконструктивно-пластических операций, показания к адъювантным методам лечения ГФ (таким как гипербарическая оксигенотерапия, вакуум-терапия); активно исследуются факторы прогноза, определяющие исход заболевания. Немалое место уделяется вопросам терминологии, классификации, этиологии и механизмам развития ГФ.
Цель предпринятого исследования заключалась в анализе современных научных представлений, касающихся вопросов терминологии, классификации и этиопатогенеза ГФ.
ИСТОРИЧЕСКАЯ СПРАВКА
Существует предположение, что первое описание болезни принадлежит Гиппократу (около 500 лет до н.э.), который рассматривал заболевание как рожистое воспаление мошонки, сопровождающееся высокой смертностью [28, 30, 34, 35]. Известный древний историк и полководец Иосиф Флавий (40-е – 90-е годы н.э.) в своих летописях «Иудейские древности» указывал, что иудейский царь Ирод Великий (70-е годы до н.э. – 4-ый год н.э.) в последние годы своей жизни страдал гангреной наружных половых органов, приведшей на фоне сахарного диабета и почечной недостаточности к мучительной смерти правителя [28, 34].
Среди отечественных ученых первое сообщение об этом заболевании принадлежит врачу-исследователю П. Добычину, который в 1862 году опубликовал наблюдение молниеносной гангрены мошонки (gangrene fulminans scrotalis). В 1865 году известным хирургом И.В. Буяльским было сделано сообщение об успешном лечении больного с гангреной мошонки, которая сопровождалась полным обнажением яичек и семенных канатиков [28].
Среди зарубежных исследователей первое сообщение о гангрене мошонки принадлежит французскому врачу Бауреньи (Н. Baurienne), описавшем в 1764 году бытовую «контузию мошонки» у 14-летнего подростка, которого боднул бык [28, 30, 35]. Некроз кожи мошонки развивался стремительно, после нескольких операций (некрэктомий) пострадавший выздоровел. И только спустя почти 120 лет, в 1883 году, парижский дерматовенеролог, профессор Жан Альфред Фурнье (J.A.Fournier, 1832-1914 гг.) у 5-ти молодых пациентов описал развитие спонтанной фудроянтной (молниеносной) гангрены полового члена (“gangrene foudroyante de la verge”) в виде самостоятельного заболевания, впоследствии названном его именем (рис. 1) [36-38]. Одним из предрасполагающих факторов заболевания Ж.А. Фурнье считал сахарный диабет, а непосредственно производящим фактором – травму урогенитальной области. В качестве травмы наружных гениталий автор рассматривал ущемление крайней плоти, вызванное перевязыванием головки полового члена, к которому прибегали некоторые его пациенты в качестве «лечения» ночного недержания мочи или средства мужской контрацепции. В своем научном исследовании Ж.А. Фурнье выделил 2 классических клинических критерия ГФ, не утративших значение и в настоящее время: (1) внезапное начало без видимых причин и (2) стремительно прогрессирующее течение болезни [37].

Рис. 1. Жан Альфред Фурнье (1832-1914) из работы [38]
ТЕРМИНОЛОГИЯ
В литературе можно встретить более 15 различных названий заболевания: «первичная гангрена мошонки», «самопроизвольная гангрена мошонки и полового члена», «эпифасциальная гангрена и субфасциальная флегмона половых органов», «гангренозная рожа мошонки», «анаэробная газовая флегмона мошонки», «идиопатическая гангрена мошонки», «молниеносная гангрена мошонки», «острый некроз тканей мошонки и полового члена», «периуретральная флегмона», «фагедема мошонки», «синергетический целлюлит», «стрептококковая гангрена мошонки», «синдром Meleney» (по имени американского хирурга F.L. Meleney, который рассматривал заболевание как стрептококковый целлюлит наружных гениталий и одним из первых в 1924 году предложил в качестве лечения ГФ неотложную некрэктомию пораженных тканей), «анаэробный целлюлит мошонки», «гангрена Фурнье», «синдром Фурнье», «болезнь Фурнье», «некротизирующий фасциит наружных гениталий, промежности и перианальной области», «облитерирующий эндартериит мошонки и промежности» [5, 12, 20, 21, 23, 28, 31, 32, 39-48].
Такое многообразие терминов является отражением различных взглядов на природу заболевания и подходов к его лечению.
В настоящее время большинство авторов в названии заболевания придерживается исторически сложившейся терминологии: «гангрена Фурнье» [20, 28, 31]. Предлагается дифференцированно подходить к использованию термина «гангрена Фурнье», а именно: именовать им все случаи молниеносной гангрены мошонки неустановленной этиологии («первичная или идиопатическая гангрена мошонки» или «гангрена Фурнье») [9]. Остальные случаи гангрены наружных гениталий с установленными каузативными факторами рассматриваются как «вторичная гангрена мошонки». Однако такая классификация ГФ не нашла поддержки в широкой литературе.
ЭПИДЕМИОЛОГИЯ
ГФ относится к крайне редким заболеваниям. Данные о частоте ГФ значительно варьируют и представлены в различных форматах измерения, затрудняющих проведение их сравнительной оценки. В США ежегодно регистрируются от 900 до 1000 случаев ГФ [12, 30]. ГФ встречается в 1,6 случаев на 100 000 мужчин в популяции в год, что составляет менее чем 0,02% всех поступлений в стационар [1]. По данным В.М. Тимербулатова и соавт. частота ГФ в нозологической структуре отделений урологического профиля, общей и гнойной хирургии составила 0,09% [39]. По данным T. Eskitascioglu и соавт. частота ГФ среди всех острых хирургических заболеваний составила 0,35% [6]. Приводятся и другие данные по частоте ГФ: 1 случай на 7500 [43], 1 случай на 5300 [45], 0,04 случая на 1000 [12] случаев всех острых хирургических заболеваний (табл. 1).
Таблица 1. Частота ГФ среди острых хирургических заболеваний
| Тимербулатов В.М. и соавт. (2009) [39] |
Altarac S. и соавт. (2012) [1] |
EskitasciogluT. и соавт. (2014) [6] |
|
|---|---|---|---|
| Частота ГФ среди острых хирургических заболеваний: % % (общее количество больных) ГФ |
0, 09 (17) | 0,02 (41) | 0,35 (80) |
Официальные сведения о заболеваемости ГФ в литературе отсутствуют. С 1950 по 2007 гг. в мировой литературе описано 3297 случаев ГФ [22]. В настоящее время число случаев ГФ, по данным PubMed, достигло почти 4000 с устойчивой тенденцией к ежегодному росту заболеваемости. По данным эпидемиологических исследований, ежегодный прирост больных ГФ за последовательные 10-летние периоды (с 1979 по 1988 гг. и с 1989 по 1998 гг.) увеличился в 2,2 раза [49], а за более длительный сравниваемый период времени (с 1950 по 1999 гг. и с 2000 по 2007 гг.) ежегодный прирост больных ГФ увеличился в 6,4 раза [5] (табл. 2). Полагают, что такая ситуация объясняется не только абсолютным увеличением заболеваемости ГФ, но и ростом доступности Интернета, позволяющего сравнительно легче опубликовать данные своих исследований (при сравнении с публикацией их на страницах научных журналов) [32].
Таблица 2. Динамика заболеваемости ГФ
| Авторы, год | Сравниваемые периоды (гг.) Ежегодное количество больных ГФ (общее количество больных ГФ за этот период) |
Ежегодный прирост больных ГФ за сравниваемые периоды времени |
|
|---|---|---|---|
| Stephens B.J. et al. (1993) [49]; Eke N. (2008)[32]; Martinschek A. et al. (2012) [17] |
1979 – 1988: 45 (449) |
1989 – 1998: 97 (973) |
в 2,2 раза |
| Ngugi P. et al. (2014) [5] | 1950 – 1999: 27,8 (1726) | 20002007: 177 (1571) | в 6,4 раза |
ГФ наблюдается в любом возрасте, поражая наружные половые органы не только у мужчин, но и у женщин. Описаны случаи ГФ, возникшей у новорожденного и в 90летнем возрасте [6, 9, 32]. По данным большинства авторов, ГФ чаще встречается у мужчин в возрасте 40-60 лет в соотношение мужчин и женщин равном 10:1 [1, 5, 11, 14, 28]. Средний возраст пациентов с ГФ имеет устойчивую тенденцию к росту (рис. 2) [1, 5, 6, 12, 14, 17].
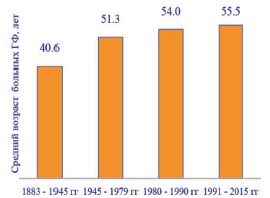
Рис. 2. Динамика роста среднего возраста пациентов с ГФ (по [1, 5, 6, 12, 14, 17])
При сравнительном анализе 450 случаев ГФ, представленных в 10-ти крупных серийных исследованиях за последние 5 лет [1, 2, 3, 6, 7, 11, 14, 15, 17, 18], общий возраст пациентов с ГФ варьировал от 14 до 89 лет. Минимальный средний возраст, максимальный средний возраст и усредненный возраст пациентов с ГФ составили 14-45 лет (25,3 ±7,6 лет), 62-89 лет (80,2±7,8 лет) и 44-60 лет (55,5±4,8 лет), соответственно (рис. 3). Более 70% пациентов – это пациенты старше 55 лет. Мужчины составили 525 (90%), женщины – 57 (10%) больных ГФ. Соотношение мужчин и женщин в среднем было 9,2:1 (2,5:1-19:1). Низкая заболеваемость ГФ у женщин объясняется анатомическими и гигиеническими особенностями промежности и наружных половых органов [5, 10, 22].
Заболеваемость ГФ среди детей встречается значительно реже. По сводным данным на 2011 год в англоязычной литературе приводится 63 случая ГФ у детей, причем у 43 (65%) из них в возрасте до трех лет [2, 5, 9, 12, 32].
Заболеваемость ГФ не связана с сезонными колебаниями и эндемичными регионами [28]. Тем не менее, в некоторых публикациях отмечена более высокая заболеваемость ГФ в странах Азии и Африки, чем в Европе и США [22, 24, 30]. Однако при этом, смертность при ГФ в США и Европе незначительно превышает показатели смертности в слаборазвитых странах, что вероятно связано с наличием антибиотикоустойчивых штаммов инфекции, возникших на фоне более широкого и нередко необоснованного применения антибактериальных препаратов в развитых странах [24, 30].
ПРЕДРАСПОЛАГАЮЩИЕ ФАКТОРЫ
Выделяют местные и общие предрасполагающие факторы, способствующие возникновению ГФ.
А. Местные предрасполагающие факторы. К ним относятся анатомические особенности наружных половых органов и промежности: а) относительная тонкость и повышенная увлажненность кожи мошонки с рыхлой и слабо развитой подкожной жировой клетчаткой, способствующие более легкому внедрению высоковирулентной микрофлоры; б) близость расположения уретры и анального канала, создающие благоприятные условия для обсеменения патогенной флорой промежности и кожи мошонки; в) невыраженная артериальная сеть и развитое венозное русло мошонки и промежности, создающие условия для замедленного оттока венозной крови, развития тромбофлебита и лимфостаза [12, 20, 28, 31, 34].
Б. Общие предрасполагающие факторы. ГФ обычно развивается у иммунокомпромиссных пациентов [2, 4, 7, 10, 13, 23]. Среди них пациенты с сахарным диабетом составляют основной контингент: 32-66% [5, 9, 22]. Сахарный диабет является основным фактором иммуносупрессии вследствие нарушения клеточного и гуморального иммунитета и развития диабетической микрои макроангиопатии, предрасполагающих к возникновению ГФ [12, 24, 48, 50]. В свою очередь ГФ, как и любое инфекционное заболевание, приводит к возрастанию скорости катаболизма, сопровождающегося увеличением эндогенной продукции глюкозы и усугублением течения сахарного диабета [12, 48]. Гипергликемия негативно влияет на бактерицидные свойства фагоцитов (угнетает адгезию и хемотаксис макрофагов), способствует снижению скорости активации Т-клеток, уменьшает выработку иммуноглобулинов IgG и IgA, компонентов комплемента С3 и С4 и в итоге приводит к снижению общего и местного (тканевого) антибактериального иммунитета [24].
К другим коморбидным заболеваниям и состояниям, прямо или косвенно приводящим к нарушением общего и местного иммунитета при ГФ, относят: хронический алкоголизм, онкологические заболевания, хроническую почечную недостаточность, ожирение, химиолучевую и кортикостероидную терапию, хроническую обструктивную болезнь легких, курение, хроническую сердечную недостаточность, ишемическую болезнь сердца, артериальную гипертензию, стеноокклюзирующий атеросклероз сосудов таза и нижних конечностей, алиментарную недостаточность, цирроз печени и печеночную недостаточность, системную красную волчанку, болезнью Крона, наркоманию, носительство ВИЧ и вируса гепатита С, длительную иммобилизацию (в частности, при острых нарушениях мозгового кровообращения, продолжительных сроках госпитализации), нарушение гигиены наружных половых органов [1, 4-6, 12, 13, 16, 17, 21, 22, 26, 27, 30, 35, 37, 48].
По данным сравнительного анализа 658 случаев ГФ, представленных в 14-ти крупных исследованиях за последние 15 лет, наиболее частыми общими предрасполагающими факторами ГФ являлись: сахарный диабет – в 56% (45-78%) случаев, хронический алкоголизм – в 45% (34-56%) и хроническая почечная недостаточность – в 34% (2345%) [1-4, 6-8, 10, 11, 13-17].
ЭТИОЛОГИЯ
Длительное время, с момента первого описания ГФ, считалось, что одной из отличительных особенностей ГФ является невозможность установить источник инфекции или идиопатический характер ГФ [20, 40, 44]. В последнее время это положение кардинально меняется. Согласно литературному анализу 1726 случаев ГФ, проведенному N. Eke, причины ГФ можно выявить в 95 – 97% случаев [32]. Более того, существует мнение, что входные ворота инфекции при ГФ могут быть установлены во всех случаях [34]. Случаи ГФ, в которых источник инфекции выявить не представляется возможным, свидетельствуют обычно о далеко зашедшей стадии и поздней диагностике заболевания [34].
В действительности, любое заболевание (или его осложнение) или травма аногенитальной зоны могут привести к развитию ГФ [22]. В литературе обсуждаются три группы причин развития ГФ: 1) заболевания и повреждения толстой кишки, 2) заболевания и повреждения мочеполовых органов, 3) заболевания и повреждения кожи и подкожной клетчатки наружных половых органов, промежности и перианальной области.
Приводятся противоречивые данные, касающиеся частоты различных факторов в генезе ГФ. Так, существует распространенное мнение, что на долю заболеваний и повреждений толстой кишки приходится 30-70% случаев ГФ, мочеполовых органов – 20-40%, кожи и подкожной клетчатки аногенитальной зоны – 20% [4, 7, 9, 12, 14, 19, 22, 26]. Однако в последнее время появились сообщения, в которых приоритет в генезе ГФ принадлежит заболеваниям (повреждениям) мочеполовых органов [20, 31] или отдается предпочтение травматическому фактору [6, 38, 48]. Травматические факторы объединяют как операционную травму (полученную в результате хирургических операций и манипуляций), так и неоперационную травму (полученную в силу различных обстоятельств военного, бытового, спортивного характера и т.д.) [6].
Для уточнения частоты причинных факторов в генезе ГФ было проанализировано 402 случая ГФ, опубликованных в доступной мировой литературе за последние 15 лет (с 2000 по 2015 гг.) [1 – 4, 6 – 8, 10]. В результате сравнительного анализа было установлено, что на долю заболеваний ободочной и прямой кишки приходится 162 (40,3%, варьирует от 20 до 72%) случая, мочеполовой сферы – 45 (11,2%, варьирует от 0 до 40%), кожи и подкожной клетчатки аногенитальной области – 41 (10,2%, варьирует от 0 до 25%). Этиология ГФ была установлена в 248 (61,7%, варьирует от 25 до 100%) случаях, в остальных – 154 (38,3%, варьирует от 0 до 75%) случаях причины ГФ остались неизвестными. Наиболее частой причиной во всех исследованиях являлся перианальный абсцесс, который был выявлен в 126 (77,8%) случаях из 162 случаев заболеваний толстой кишки. Среди заболеваний мочеполовой сферы преобладали гнойно-воспалительные заболевания уретры, предстательной железы и органов мошонки (более чем в 50% случаев); среди заболеваний кожи и подкожной клетчатки – различные виды травм (операционные и неоперационные травмы, примерно поровну в каждом случае). При сравнении этих 402 случаев ГФ со 198 случаями ГФ, приведенными в литературном обзоре J. Hubert и соавт. [12], за более ранний 15-летний период (с 1981 по 1995 гг.) было установлено, что частота заболеваний толстой кишки и кожи аногенитальной зоны за два сравниваемых периода времени (с 2000 по 2015 гг. и с 1981 по 1995 гг.) были сопоставимы между собой (рис. 4). За последние 15 лет отмечается уменьшение (почти в 3 раза) в генезе ГФ доли заболеваний мочеполовой сферы (11,2% против 33%). Обращает на себя внимание факт увеличения (более чем в 12 раз) количества случаев с неустановленной этиологией (38,3% против 3%), что не подтверждает приведенные выше данные литературы о росте случаев ГФ с установленной этиологией [32, 34]. Причины этих тенденций пока неясны и нуждаются в дальнейшем изучении.
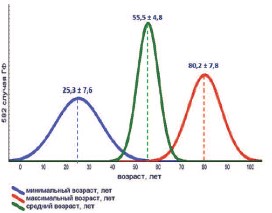
Рис. 3. Распределение пациентов с ГФ по возрасту (по [1, 2, 3, 6, 7, 11, 14, 15, 17, 18])
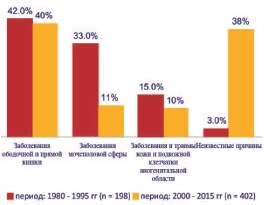
Рис. 4. Сравнительная оценка причин ГФ за периоды 2015 2000 гг. и 1995 1981 гг. (по [1 4, 6 8, 10])
Заболевания и травмы толстой кишки, приводящие к ГФ, включают перианальные и периректальный абсцессы, анальные трещины, проктит, свищевую форму парапроктита, ущемленные паховые и пахово-мошоночные грыжи, перфоративный аппендицит, дивертикулиты ободочной кишки, инородные тела толстой кишки, перфорацию толстой кишки при колоректальном раке, травматические и инфекционные осложнения фиброколоноскопии и ректороманоскопии, геморроидэктомии по Миллигану – Моргану, биопсии прямой кишки [1-20, 25, 31, 37, 51, 52].
Урологические заболевания и травмы, приводящие к ГФ, включают различные острые гнойные заболевания уретры и парауретральных мягких тканей, мочевого пузыря при нейрогенном мочевом пузыре, предстательной железы, семенных пузырьков, бульбоуретральных желез, мошонки и ее органов; осложнения трансуретральной резекции предстательной железы и мочевого пузыря, катетеризации мочевого пузыря, пластики уретры по поводу стриктуры и уретро-ректальных свищей, фаллопротезирования, вазэктомии, пластики оболочек яичка по поводу гидроцеле, трансректальной биопсии предстательной железы [1-20, 25, 31, 37, 49, 50].
Заболевания и травмы кожи и подкожной клетчатки аногенитальной зоны, приводящие к ГФ, включают различные гнойные заболевания и инфицированные травмы кожи полового члена, мошонки и промежности, парафимоз, травму полового члена при анальном и оральном сексе, баланопостит; осложнения инъекций эректогенных препаратов в кавернозные тела полового члена и инъекций маслои парафиносодержащих веществ в крайнюю плоть головки полового члена [1-20, 25, 31, 37, 49, 50] (таб. 3).
Таблица 3. Этиологические факторы при ГФ ( по [1 – 20, 25, 31, 37, 51, 52])
| Желудочно-кишечный тракт | Мочеполовой тракт | Кожа и подкожная клетчатка наружных половых органов и промежности |
|
|---|---|---|---|
| Заболевания и травмы |
|
|
|
| Операции и манипуляции |
|
|
|
У женщин дополнительные факторы развития ГФ включают абсцессы вульвы и бартолиновых желез, септический аборт, генитальный пирсинг и эпиляция; травматические и инфекционные осложнения пангистерэктомии; перинеотомиии и симфизиотомии, применяемых во время трудных родов [5, 9, 10, 12, 32].
Укусы насекомых, ожоги, травмы наружных половых органов; обрезание крайней плоти характерны для развития ГФ у детей [2, 5, 28, 31, 48].
КАУЗАТИВНАЯ ФЛОРА
J.A. Fournier предполагал, что ГФ вызывается стрептококковой инфекцией [12, 36]. В 1924 году американский хирург F.L. Meleney сообщил о 20 случаях ГФ в одной из китайских провинций, вызванных Streptococcus pyogenes [40]. В течение последующего 30-летнего периода ГФ рассматривалась исключительно как «стрептококковая гангрена мошонки» или «болезнь Meleney», которая характеризовалась выраженной токсемией и высокой летальностью. В 1952 году английский хирург B. Wilson для обозначения глубокой инфекции мягких тканей предложил термин «некротизирующий фасциит» и предположил полимикробную этиологию ГФ, которая нашла подтверждение в последующих работах [12, 24, 30, 45-47].
В настоящее время ГФ рассматривается как некротизирующий фасциит аногенитальной области полимикробной этиологии [1-5, 17, 20, 43]. Микробные ассоциации, обнаруживаемые при ГФ, обычно состоят из 4-5 типов (максимально – до 9 типов) аэробных и анаэробных микроорганизмов, некоторые из которых являются комменсалами (образуют сообщества и в норме обитают на коже наружных гениталий и промежности) [12, 22, 24, 29]. Наиболее распространенной каузативной флорой среди аэробных микроорганизмов являются кишечная палочка, пневмоническая клебсиелла и золотистый стафилококк, в том числе метициллин-резистентные штаммы стафилококка; среди анаэробных микроорганизмов преобладают бактероиды, относящиеся к нормальной микрофлоре кишечника [1, 4, 18, 33] (табл. 4). В микробной ассоциации при ГФ аэробная микрофлора является доминирующей [6, 8, 21]. Такое преобладание аэробной микрофлоры может быть абсолютным и относительным (вследствие возможной гибели анаэробной микрофлоры при бактериологических исследованиях в аэробной среде) [17, 23].
Таблица 4. Каузативная микрофлора при ГФ (по [1, 4, 18, 33])
| Грамотрицательные бактерии |
Грамположительные бактерии Streptococcus |
Анаэробные бактерии |
Грибы |
|---|---|---|---|
| Fusobacterium Salmonella Escherichia coli Enterobacter Proteus Klebsiella Serratia Pseudomonas Shigella Neisseria Pasteurella |
Streptococcus Staphylococcus Corynebacterium |
Bacteroides Clostridium Peptococcus |
Candida Histoplasma Cryptococcus |
Сравнительный анализ каузативной микрофлоры в 692 случаях ГФ, представленных в литературе за периоды 1980 – 1995 гг и 2000 – 2015 гг. [1-20, 25, 31, 37, 49, 50, 53], показал, что за последние 15 лет в генезе ГФ отмечается рост удельного веса аэробной флоры за счет кишечной группы (E.coli, Proteus, Pseudomonas) при одновременном уменьшении анаэробных бактерий. В преобладающем количестве случаев, каузативную флору удается идентифицировать. Почти в 50% случаев она была представлена микробной ассоциацией в количестве от 1 до 4 типов микроорганизмов в одной ассоциации. Лидирующие позиции занимает кишечная палочка: более половины всех микробных ассоциаций (табл. 5, 6).
Таблица 5. Сравнительная оценка каузативной микрофлоры при ГФ за периоды 2015 2000 гг. и 1995 1980 гг. ( по [1 – 20, 25, 31, 39, 51 53])
| Каузативная флора | 2015 – 2000 гг. n= 350 | 1995 – 1980 гг. n = 342 |
|---|---|---|
| 1. Аэробная флора | 0 – 85,6% | 23 – 53 % |
| Enterobacteriаceae | 56,8% (14,7 – 85,6%) | 31,3% (23 – 53%) |
| Staphylococcus | 13,6% (4,4 – 25,4%) | 29% |
| Streptococcus | 12,8% (0 – 30,9%) | 42% |
| 2. Анаэробная флора | 5,6 – 20,9% | 4 – 46% |
| Сlostridium | 20,9% (0 – 67,3%) | 10% |
| Bacteroides | 7,9% (0 – 27,0%) | 46% |
| Peptostreptococcus | 5,6% (0 – 33,3%) | 24% |
Таблица 6. Характеристика каузативной микрофлоры при ГФ (по [1 – 20, 25, 31, 37, 49, 50, 51])
| Количество наблюдений, n |
Микрофлора идентифицирована (% случаев) |
Микрофлора не идентифицирована (% случаев) |
Монофлора (% случаев) |
Микробные ассоциации (% случаев) |
Количество микробов в каждом случае mean % (min – max) |
|---|---|---|---|---|---|
| n = 350 | 86,2 (76-92,5) | 13,5 (7,5-24,0) | 3,4 (0-16,2) | 49,0 (17,5-83,8) | 49,0 (17,5-83,8) |
ПАТОГЕНЕЗ
Существует несколько теорий патогенеза ГФ, некоторые из которых представляют сегодня лишь исторический интерес. К ним относятся: теория мочевой инфильтрации промежности [43], теория местного инфекционного лимфангита мошонки [47], теория острого артериального тромбоза мошонки [44], теория сочетанного действия высоковирулентной инфекции и сосудистого тромбоза мошонки и промежности [45], теория локального внутрисосудистого свертывания [48]. Все эти теории придают значение отдельным причинным факторам и звеньям патогенеза, не представляя картину развития ГФ в целом.
В настоящее время многие аспекты патогенеза ГФ являются хорошо изученными. Создана общая модель патогенеза ГФ, поддерживаемая многими авторами, согласно которой ГФ рассматривается как быстро прогрессирующая форма некротизирующего фасциита наружных половых органов и промежности полимикробной этиологии [21, 24, 48, 54]. Согласно одной точки зрения, ГФ начинается с локального воспаления подкожной клетчатки (целлюлита), возникающего в области входных ворот инфекции [28, 31, 54]. В дальнейшем инфекционно-воспалительный процесс распространяется на кожу и вглубь – на фасции и мышцы. Согласно другой, более распространенной, точке зрения, первично поражается поверхностная (подкожная) фасция с последующим вовлечением окружающих тканей в воспалительный процесс [34, 39, 48, 51]. К входным воротам инфекции относятся уретра, прямая кишка и кожа промежности. В развитии ГФ придается значение различным факторам: а) нарушению целостности эпидермиса, дермы и фасций при травме [1, 6, 31]; б) распространению инфекции на промежность из соседних областей (клетчатки перианальной области, малого таза и забрюшинного пространства) по продолжению или per continuitatem (по ходу фасциальных структур) [16, 20, 22]; в) лимфогематогенному распространению инфекции на промежность из брюшной полости [12].
В качестве наиболее вероятного пускового механизма развития некроза фасций рассматривается высоковирулентная инфекция, которая инициирует последовательный каскад реакций в очаге воспаления: цитокиновый каскад, приводящий к повреждению сосудистого эндотелия, который в свою очередь посредством освобождения тромбопластина активирует следующий – коагуляционный каскад, приводящий к ингибированию фибринолиза с образованием диссеминированного тромбоза мелких сосудов, питающих фасцию [21, 34]. Кроме того, повреждение эндотелия приводит к экстравазации жидкой части крови, отеку тканей, лейкоцитарной инфильтрации, усугубляющих в условиях замкнутого тканевого пространства нарушение микроциркуляции, что приводит, в конечном счете, к прогрессированию ишемического некроза фасций [28, 34]. Возникающий тромбоз кожных и подкожных сосудов способствует внедрению инфекции в более глубокие отделы мягких тканей через межфасциальные пространства. Скудная артериальная сеть и густое венозное русло создают условия для замедленного оттока венозной крови, развития тромбофлебита и лимфостаза. Нарастающий при этом отек мягких тканей способствует дальнейшему нарушению артериального кровотока, прогрессированию ишемии и развитию геморрагического инфаркта мошонки [20, 21, 31].
Одним из ключевых звеньев патогенеза ГФ является синергетическое взаимодействие каузативной микрофлоры [4, 5, 7, 11, 22, 28, 31, 53]. Синергетическое взаимодействие аэробной и анаэробной микрофлоры подразумевает совместное действие бактериальных ферментов и токсинов, способствующих быстрому распространению инфекции в мягких тканях [28, 30]. Аэробные бактерии с самого начала становятся лидерами микробных ассоциаций, определяя характер и динамику воспалительного процесса [24, 48]. Септицемия, наблюдаемая при ГФ, обусловлена, как правило, стрептококками [40, 41, 46].
Бактериальное взаимодействие при ГФ можно пояснить одним следующих примеров. Аэробные микроорганизмы (микрофлора «первой линии атаки») продуцируют фермент коагулазу, повышающий коагуляцию в сосудах. Тромбоз этих сосудов снижает локальный кровоток и оксигенацию тканей, создавая тем самым условия для деятельности анаэробных бактерий. Кроме того, в результате жизнедеятельности аэробных бактерий, накапливающиеся продукты обмена снижают окислительно-восстановительный потенциал тканей, что также истощает запасы кислорода в зоне поражения и дополнительно приводит к ингибированию фагоцитоза [5, 22, 24, 54]. В результате тканевой гипоксии факультативные анаэробы (микрофлора «второй линии атаки») начинают активно размножаться и продуцировать ферменты лецитиназу, коллагеназу, вызывающие гистолиз [5, 9, 28, 31, 48]. В частности, клостридиальный альфатоксин вызывает обширный отек мягких тканей и массивный некроз фасций и мышц, сопровождающиеся продукцией газа, гемолизом и выраженной токсемией. Газ, являющийся побочным продуктом анаэробного метаболизма, в основном состоит из азота, закиси азота, водорода и сероводорода [4, 18, 27, 38]. Гистолитическая активность микробных ферментов позволяет микроорганизмам быстро преодолевать межтканевые барьеры, в том числе проникать через фасции в подлежащие мышцы (рис. 5).
Выход воспалительного процесса за пределы одной анатомической области обусловлен обширными анатомическими связями фасций промежности, передней брюшной стенки, малого таза и забрюшинного пространства [12, 21, 31, 54] (рис. 6, 7). Фасциальный некроз, захватывающий поверхностную и глубокую фасции, распространяется со стремительной скоростью: 2-3 см в час [32]. Распространение инфекции по межфасциальным пространствам приводит к поражению нескольких анатомических регионов [20, 31]. Инфекция, возникшая в аногенитальной зоне, может распространиться по фасции Коллеса (поверхностной фасции промежности) на мошонку и половой член (вдоль мясистой фасции, являющейся продолжением фасции Коллеса) [54]. Она также может переходить вдоль фасции Скарпа (продолжение фасции Коллеса) на переднюю брюшную стенку и подниматься вверх до ключиц и подмышечных впадин [20, 27, 34]. При нарушении целостности фасции Коллеса инфекция может распространиться на седалищно-прямокишечную ямку с обеих сторон и впоследствии – на ягодицы и бедра. Если нарушается целостность глубокой фасции промежности (фасции Бака), то инфекция может распространиться выше мочеполовой диафрагмы – в клетчатку перивезикального и забрюшинного пространства, а затем – в мошонку (по ходу семявыносящего протока через фасциальные футляры семенного канатика) [45, 48, 54] (рис. 8). У женщин, источник инфекции при ГФ, как правило, возникает из абсцессов вульвы или бартолиновых желез [22].
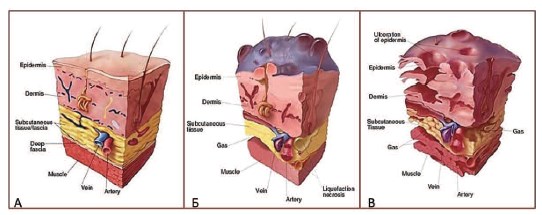
Рис. 5. Патоморфологические изменения кожи и мягких тканей при ГФ. А – норма, Б – ранняя (буллезная) стадия ГФ (некроз поверхностной фасции, подкожная эмфизема, буллезные изменения кожи), В – поздняя (язвенная) стадия ГФ (присоединение язвенно-некротических изменений кожи) (по [24])
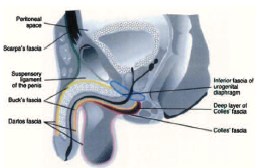
Рис. 6. Топография фасций промежности, наружных половых органов и передней брюшной стенки. Сагиттальная плоскость (по [54])
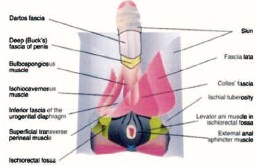
Рис. 7. Топография фасций промежности и наружных половых органов. Фронтальная плоскость (по [54])
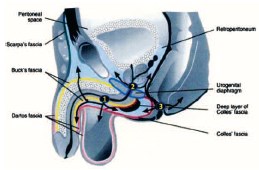
Рис. 8. Пути распространения ГФ (по [54]). 1 – при заболеваниях передней уретры, 2 – при заболеваниях задней уретры, 3 – при заболеваниях анальной области
Таким образом, в сложном патогенезе ГФ можно выделить 4 основных взаимосвязанных фактора: 1) гнойно-воспалительные заболевания и/или травма аногенитальной области в качестве пускового механизма, 2) синергетическое действие высоковирулентной аэробной и анаэробной инфекции, 3) острое нарушение кровообращения в мягких тканях аногенитальной области, 4) снижение иммунной реактивности организма [20, 31] (рис. 9).
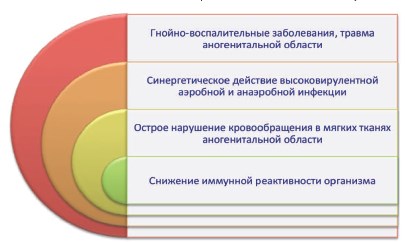
Рис. 9. Основные факторы патогенеза ГФ (по [20, 31] с дополнениями)
Кавернозные тела полового члена, спонгиозное тело уретры, яички, придатки и семенные канатики крайне редко поражаются при ГФ ввиду раздельного кровоснабжения этих органов и мошонки (из системы срамных артерий и брюшного отдела аорты, соответственно) [26, 28, 34, 37]. Тем не менее, в отдельных исследованиях вовлечение полового члена и органов мошонки в инфекционнонекротический процесс при ГФ наблюдается не так уж редко: в 10 – 30% случаев [13, 16, 37]. При анализе 611 случаев ГФ, представленных в 12 публикациях за последние 15 лет [1-20, 31, 37], сочетанная локализация ГФ в области мошонки и полового члена была отмечена у 275 (45%) больных. При этом орхиэктомия, пенэктомия и вазэктомия были выполнены в 28 (4,6%), 1(0,2%) и 1 (0,2%) случаях, соответственно. При патогистологическом исследовании обнаруживались некроз яичек и воспалительный процесс разной степени выраженности [13, 37].
ЗАКЛЮЧЕНИЕ
Первое подробное описание молниеносной гангрены наружных гениталий и промежности принадлежит французскому дерматовенерологу, профессору Ж.А. Фурнье (1883). В литературе можно встретить более 15 различных названий заболевания, отражающих различные взгляды на природу заболевания. Общепринятым термином в названии заболевания является «гангрена Фурнье»
ГФ относится к крайне редким заболеваниям с тенденцией к ежегодному росту заболеваемости. За последнее десятилетие заболеваемость ГФ возросла в 2,2 – 6,4 раза, что, прежде всего, связано с увеличением количества иммунокомпромиссных пациентов, составляющих основной контингент больных ГФ. Средний возраст пациентов с ГФ неуклонно увеличивается и в настоящее время составляет 55,5 лет. ГФ страдают преимущественно мужчины в соотношении к женщинам 9,2 к 1. Среди детей ГФ встречается крайне редко.
Выделяют местные и общие предрасполагающие факторы развития ГФ. К местным предрасполагающим факторам относятся анатомические особенности строения и кровоснабжения наружных половых органов и промежности. Среди общих предрасполагающих факторов лидирующие позиции занимают сахарный диабет (45 – 78% случаев), хронический алкоголизм (34 – 56% случаев) и хроническая почечная недостаточность (23 – 45% случаев).
Источники инфекции при ГФ включают заболевания и повреждения толстой кишки (20 – 72% случаев), мочеполовых органов (до 40% случаев), кожи и подкожной клетчатки наружных половых органов, промежности и перианальной области (до 25% случаев). В действительности, любое заболевание (или его осложнение) или травма аногенитальной зоны могут привести к развитию ГФ. Источники инфекции можно установить более чем в половине случаев ГФ. Наиболее частой причиной ГФ является перианальный абсцесс (почти 80% всех случаев ГФ). За последние 15 лет отмечаются уменьшение (почти в 3 раза) доли заболеваний мочеполовой сферы в генезе ГФ и увеличение (более чем в 12 раз) количества случаев ГФ с неустановленной этиологией.
Каузативная микрофлора при ГФ представлена микробными ассоциациями из 4 – 5 аэробных и анаэробных микроорганизмов. Наиболее распространенной каузативной микрофлорой в микробной ассоциации является кишечная палочка (более 50% всех случаев).
В настоящее время ГФ рассматривается как одна из форм некротизирующего фасциита с поражением аногенитальной области. В патогенезе ГФ придается значение гнойновоспалительным заболеваниям и травме аногенитальной области (в качестве триггерного механизма, синергетическому действию высоковирулентной аэробной и анаэробной инфекции, острому нарушению кровообращения в мягких тканях аногенитальной области и снижению иммунной реактивности организма. Совместное действие аэробной и анаэробной микрофлоры сопровождается продукцией эндои экзотоксинов, плазмокоагулирующих и гистолитических ферментов, вызывающих тромбоз сосудов, некроз подкожных поверхностных и глубоких мягких тканей и фасций промежности и наружных гениталий. Инфекционно-воспалительный процесс при ГФ стремительно, со скоростью 2 – 3 см в час, распространяется вдоль фасциальных влагалищ с промежности на мошонку, половой член, ягодицы, бедра и переднюю брюшную стенку, поднимаясь вверх до ключиц и подмышечных впадин. Вовлечение яичек и полового члена в инфекционно-некротический процесс при ГФ наблюдается очень редко: в 4,6% и 0,2% случаев, соответственно. Изучение предрасполагающих, этиологических, каузативных и патогенетических аспектов заболевания является предметом дальнейших исследований в целях выработки эффективных мер профилактики и лечения такого тяжелейшего страдания, к каким относится ГФ.
ЛИТЕРАТУРА
1. Altarac S, Katušin D, Crnica S, Papeš D, Rajković Z, Arslani N. Fournier’s gangrene: etiology and outcome analysis of 41 patients. // Urol Int. 2012. Vol. 88, N 3. P. 289-293.
2. Rouzrokh M, Tavassoli A, Mirshemirani A. Fournier’s gangrene in children: report on 7 cases and review of literature. // Iran J Pediatr. 2014. Vol. 24, N 5. P. 660-661.
3. Benjelloun el B, Souiki T, Yakla N, Ousadden A, Mazaz K, Louchi A, Kanjaa N, Taleb KA. Fournier’s gangrene: our experience with 50 patients and analysis of factors affecting mortality. // WJES. 2013. Vol. 8, N 13. P. 1-5.
4. Oguz A, Gümüş M, Turkoglu A, Bozdağ Z, Ülger BV, Agaçayak E, Böyük A. Fournier’s gangrene: a summary of 10 years of сlinical experience. // Int Surg. 2015. Vol. 100, N 5. P. 934-941.
5. Ngugi P, Magoha G, Nyaga P. Fournier’s gangrene in the HIV era. // Afr Health Sci. 2014. Vol. 14, N 4. P. 1063-1068.
6. Eskitaşcıoğlu T, Özyazgan I1, Coruh A1, Günay GK1, Altıparmak M1, Yontar Y1, Doğan F1. Experience of 80 cases with Fournier’s gangrene and “trauma” as a trigger factor in the etiopathogenesis. // Ulus Travma Acil Cerrahi Derg. 2014. Vol. 20, N 4. P. 265-274.
7. Ersoz F, Sari S, Arikan S, Altiok M, Bektas H, Adas G, Poyraz B, Ozcan O.Factors affecting mortality in Fournier’s gangrene: experience with fifty-two patients. // Singapore Med. J. 2012. Vol. 53, N 8. P. 537-540.
8. Ersay A, Yilmaz G, Akgun Y, Celik Y. Factors affecting mortality of Fournier’s gangrene: review of 70 patients. // ANZ J Surg. 2007. Vol. 77, N 1-2. P. 43-48.
9. Schultz D, Mohor CS, Solovan C. Unusual foreign body in the sigmoid colon, chronic alcohol abuse, and Fournier gangrene: a case report. // Clin Interv Aging. 2015. Vol. 31, N 10. P. 673-677.
10. Sinha R, Arachchi A, Lee P, Marwan K. Fournier gangrene in pregnancy. // Obstet Gynecol. 2015. Vol. 125, N 6. P. 1342-1344.
11. Fall B, Fall PA, Diao B, Kpatcha MR, Sow Y, Kabore FA, Ali M, Ndoye AK, Ba M. Fournier’s gangrene; a review of 102 cases. // Andrologie. 2009. Vol. 19. N 1. P. 45 – 49.
12. Hubert J, Fournier G, Mangin Ph, Punga-Maole M. Gangrene des organs genitaux externes. // Progress en Urologie. 1995. Vol. 5. P. 911-924.
13. Ghnnam WM. Fournier’s gangrene in Mansoura Egypt: a review of 74 cases. // J Postgrad Med. 2008. Vol. 54, N 2. P. 106-109.
14. Khandelwal R, Chintamani, Tandon M. Fournier’s gangrene severity index as a predictor of outcome in patients with Fournier’s gangrene: a prospective clinical study at a tertiary care center. // J Young Med Researchers. 2013. Vol. 1, N 1. P. 1-5.
15. Koukouras D, Kallidonis P, Panagopoulos C, Al-Aown A, Athanasopoulos A, Rigopoulos C, Fokaefs E, Stolzenburg JU, Perimenis P, Liatsikos E.Fournier’s gangrene, a urologic and surgical emergency: presentation of a multi-institutional experience with 45 cases. // Urol Int. 2011. Vol. 86, N 2. P. 167-172.
16. Korkut M, Içöz G, Dayangaç M, Akgün E, Yeniay L, Erdoğan O, Cal C. Outcome analysis in patients with Fournier’s gangrene: report of 45 cases. // Dis Colon Rectum. 2003. Vol. 46, N 5. P. 649-652.
17. Martinschek A, Evers B, Lampl L, Gerngroß H, Schmidt R, Sparwasser C. Prognostic aspects, survival rate, and predisposing risk factors in patients with Fournier’s gangrene and necrotizing soft tissue infections: evaluation of clinical outcome of 55 patients. // Urol Int. 2012. Vol. 89, N 2. P. 173-179.
18. Sallami S, Maalla R, Gammoudi A, Ben Jdidia G, Tarhouni L, Horchani A.Fournier’s gangrene: what are the prognostic factors? Our experience with 40 patients. // La Tunisie Medicale. 2012. Vol. 90, N 10. P. 708-714.
19. Unalp HR, Kamer E, Derici H, Atahan K, Balci U, Demirdoven C, Nazli O, Onal MA.Fournier’s gangrene: evaluation of 68 patients and analysis of prognostic variables. // J Postgrad Med. 2008. Vol. 54, N 2. P. 102-105.
20. Алиев С.А., Алиев Е.С, Зейналов В.М. Болезнь Фурнье в свете современных представлений. // Хирургия. 2014. N 4. С. 34-39.
21. Гринев М.В., Сорока И.В., Гринев К.М. Гангрена Фурнье – клиническая разновидность некротизирующего фасциита. // Урология. 2007. N 6. С. 69-73.
22. Mallikarjuna MN, Vijayakumar A, Patiel VS, Shivswamy BS. Fournier’s gangrene: current practices. // ISRN Surgery. 2012. Vol. 2012. Article ID 942437. 8 pages. doi: 10.5402/2012/942437.
23. Wróblewska M, Kuzaka B, Borkowski T, Kuzaka P, Kawecki D, Radziszewski P. Fournier’s gangrene – current concepts. // Polish J. of Microbiol. 2014. Vol. 63, N 3. P. 267-273.
24. Hakkarainen TW, Kopare NM, Fellow B, Evans HL. Necrotizing soft tissue infections; review and current concepts in treatment, systems of care, and outcomes. // Curr Probl Surg. 2014. Vol. 51, N 8. P. 344-362.
25. Al Shukry S, Ommen J. Necrotizing fasciitis – report of 10 cases and review of recent literature. // J Med Life. 2013. Vol. 6, N 2. P. 189-194.
26. Madera G., Holguin P., De Provens C.P. Genital necrotizing fasciitis. // Emergencias. 2011. Vol. 23. N 4. P. 339-340.
27. Khamnuan P, Chongruksut W, Jearwattanakanok K, Patumanond J, Yodluangfun S, Tantraworasin A. Necrotizing fasciitis: risk factors of mortality. // Risk Manag Healthc Policy. 2015. N 8. P. 1-7.
28. Ефименко Н.А., Привольнев В.В. Гангрена Фурнье. // Клин. микробиол. антимикроб. химиотер. 2008. Том 10, N 1. С. 34-42.
29. Thwaini A, Khan A, Malik A, Cherian J, Barua J, Shergill I, Mammen K. Fournier’s gangrene and its emergency management. // Potgrad Med J. 2006. Vol. 82, N 970. P. 516-519.
30. Sroczyński M, Sebastian M, Rudnicki J, Sebastian A, Agrawal AK. A comlex approach to the treatment of Fournier’s gangrene. // Adv Clin Exp Med. 2013. Vol. 22, N 1. P. 131-135.
31. Алиев С.А., Рафиев С.Ф., Рафиев Ф.С., Алиев Е.С. Болезнь Фурнье в практике хирурга. // Хирургия. 2008. N 11. С. 58 – 63.
32. Eke N. Fournier’s gangrene, still an enigma. // J Postgrad. Med. 2008. Vol. 54, N 2. P. 83-84.
33. Sorensen MD, Krieger JN, Rivara FP, Klein MB, Wessells H. Fournier’s gangrene: management and mortality predictors in a population based study. // J Urol. 2009. Vol. 182, N 6. P. 2742-2747.
34. Черепанин А.И., Светлов К.В., Чернов А.Ф., Бармин Е.В. Другой взгляд на «болезнь Фурнье в практике хирурга». // Хирургия. 2009. N 10. С. 47-50.
35. D’Arena G, Pietrantuono G, Buccino E, Pacifico G, Musto P. Fournier’s gangrene complicating hematologic malignancies: a case report and review of literature. // Mediterr J Hematol Infect Dis. 2013. Vol. 5, N 1. e2013067.
36. Fournier JA. Gangrene foudroyante de la verge. // Semaine Med. 1883. Vol. 3. P. 345-350.
37. Кистенева О.А., Кистенев В.В. Жан Альфред Фурнье – основоположник европейской венерологии и дерматологии (к 100-летию со дня смерти). // Вестник дерматол. и веренерол. 2014. N 6. С. 177-181.
38. Smith G.L., Bunker C.B., Dinneen M.D. Fournier’s gangrene. // Br J Urol. 1998. Vol. 81, N 3. P. 347-355.
39. Тимербулатов В.М., Хасанов А.Г., Тимербулатов М.В. Гангрена Фурнье. // Хирургия. 2009. N 3. С. 26-28.
40. Paz Maya S, Dualde Beltran D, Lemercier P, Leiva-Salinas C. Necrotizing fasciitis: an urgent diagnosis. // Skeletal Radiol. 2014. Vol. 43, N 5. P. 577-589.
41. Shyam DC, Rapsang AG. Fournier’s gangrene. // Surgeon. 2013. Vol. 11, N 4. P. 222-232.
42. Meleney FL. Hemolytic Streptococcus gangrene. // Arch Surg. 1924. Vol. 9. P. 317-321.
43. Parry N. Fournier gangrene. // Clin. Case Rep. 2015. Vol. 3, N 3. P. 198-199.
44. Bejanga B.L. Fournier’s gangrene. // Br J Urol. 1979. Vol. 51, N 4. P. 312-316.
45. Campbell J.C. Fournier’s gangrene. // Br J Urol. 1955. Vol. 27, N 2. P. 106-115.
46. Fontaine JL, Grosshans E, Fontaine RA. A propos de 3 nouvelles observations de gangrene d’originegazeuse don’t l’unecertainement en rapport avec unecryoglobulinemie. // Ann Chir. 1970. Vol. 24, N 23. P. 1287-1299.
47. Jones RB, Hirschmann JV, Brouwn GS, Tremann JA. Fournier’s syndrome: necrotizing subcutaneous infection of the male genitalia. // J Urol. 1979. Vol. 122, N 3. P. 279-282.
48. Germain M, Lenriot JP, Zazzo JF, Martin E. Le syndrome de Fournier. Gangrene des organs genitaux externs. Revue generale. Nouvelle hypothese pathogenique. // Ann Chir. 1977. Vol. 31, N 3. P. 249-254.
49. Stephens BJ, Lathrop JC, Rice WT, Gruenberg JC. Fournier’s gangrene: historic (17641978) versus contemporary (1979-1988) differences in etiology and clinical importance. // Am Surg. 1993. Vol. 59, N 3. P. 149-154.
50. Devajit CS, Rapsang AG. Fournier’s gangrene. // Surgeon. 2013. Vol. 11, N 4. P. 222.
51. Wang L, Han X, Liu M, Ma Y, Li B, Pan F, Li W, Wang L, Yang X, Chen Z, Zeng F. Experience in management of Fournier’s gangrene: a report of 24 cases. // J Huazhong Univ Sci Technolog Med Sci. 2012. Vol.32, N 5. P. 719-723.
52. Marin AG, Gil JM, Rodrigues AV, Rodríguez TS, Palacios JT, Oliver JL, Fuentes FT. Fournier’s gangrene: analysis of prognostic variables in 34 patients. // Eur J Trauma Emerg. Surg. 2011. Vol. 37, N 2. P. 141-145.
53. Perkins TA, Bieniek JM, Sumfest JM. Solitary Candida albicans infection causing Fournier gangrene and review of fungal etiologies. // Rev Urol. 2014. Vol. 16, N 2. P. 95-98.
54. Rajan DK, Scharer KA. Radiology of Fournier’s gangrene. // Am J Roentgenol. 1998. Vol. 170, N 1. P. 163-168.
Статья опубликована в журнале”Экспериментальная и клиническая урология” №4 2015, стр.76-85